 产业资讯
产业资讯
 医药魔方
医药魔方  2023-08-11
2023-08-11
 2569
2569
创新药国际化是一件“知易行难”的事情。在国内市场内卷的情况下,拓展国际市场永远是一句正确的口号。当前些年资金充足的时候,行业的高景气度也让企业在国际化临床开发这件事情上有充足底气的容错,资金、人才、效率、经验这些看得见的成本似乎都不是障碍,中美IND双报也成为诸多Biotech公司的标配。
但是随着近两年资金水龙头的关紧和行业景气度的降低,很多公司不得不精打细算过日子,管线和人员都在压缩,国际化临床开发这种极其烧钱的事情自然也就不在日程上。创新药国际化,成为少数有实力的勇敢者参与的游戏。
近日,亚盛医药的Bcl-2抑制剂lisaftoclax(APG-2575)获FDA批准开展注册性III期临床试验,意味着加码国际市场竞争的中国创新药军团又加一员。值得一提的是,APG-2575是第一个赴美开展全球注册性III期临床的国产Bcl-2抑制剂,同时也是第一个进入III期阶段的国产Bcl-2抑制剂。鉴于III期临床是新药开发中成本投入最大、进度也比较受外界关注的一个环节,我们在此也专门对在美国开展注册III期临床的中国创新药项目和公司做一统计分析,看看中国创新药的国际化进程是处于怎样一个阶段。
医药魔方Trialcube数据库统计结果显示,中国药企目前在美国发起的全球注册性III期临床试验已经有79项,数量已经不少。不过从数量变化趋势上看,III期试验的数量在2021年达到了峰值后(17项),近两年已开始回落,这也与近两年产业大环境的变化一致。
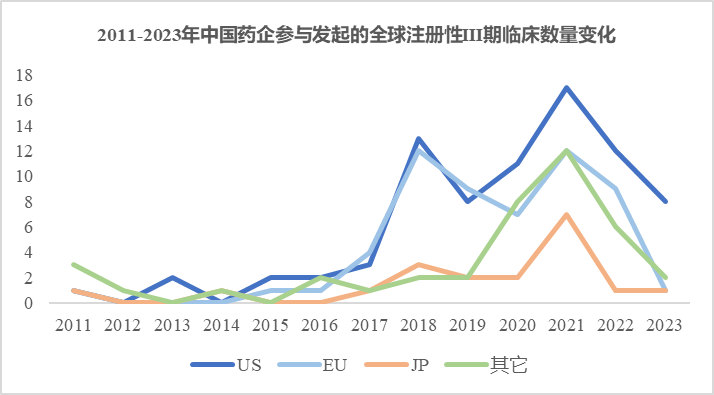
注:统计包括进行中、已完成和已终止状态的III期临床。
从公司来看,国产创新药美国III期临床试验的发起人中,半数以上为Biotech或Biopharma公司,传统药企的身影并不多见。其中又以百济神州的数量最多,一共发起了12项美国注册性III期临床,信达生物、恒瑞医药、再鼎医药、和黄医药和海思科紧随其后。
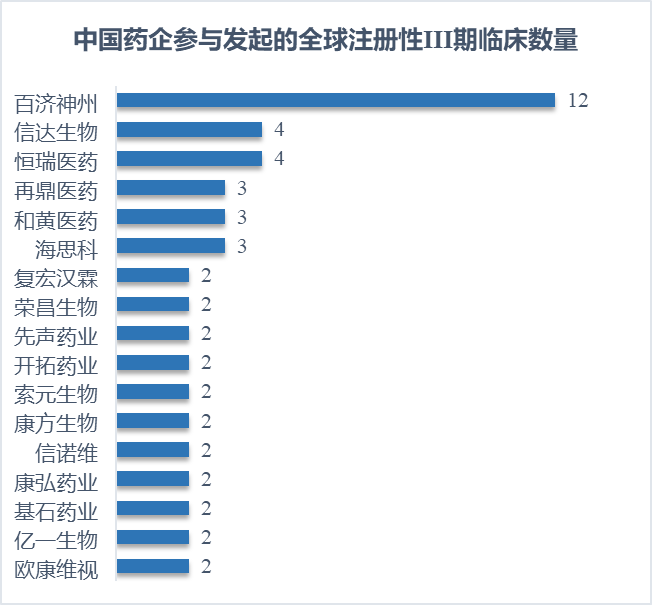
注:此处仅列出总数在2项以上的企业。试验地区以美国为主。
百济神州作为国际化标杆企业,在国际化临床开发上取得了出色成绩。BTK抑制剂泽布替尼开展了9项全球III期临床,并且在PK伊布替尼的III期ALPINE研究中取得了优效结果,成功获得欧美主流市场认可,也借此被纳入美国NCCN指南I类推荐方案。今年上半年,泽布替尼的销售额达到5.197亿美元,年底有望把中国首个“十亿美元分子”的美誉收入囊中。从靶点的角度来看,79项海外III期临床中,打头阵的是PD-1药物,包括替雷利珠单抗、信迪利单抗、卡瑞利珠单抗、斯鲁利单抗等8款PD-1单抗,这些产品开展的全球III期临床多达17项。
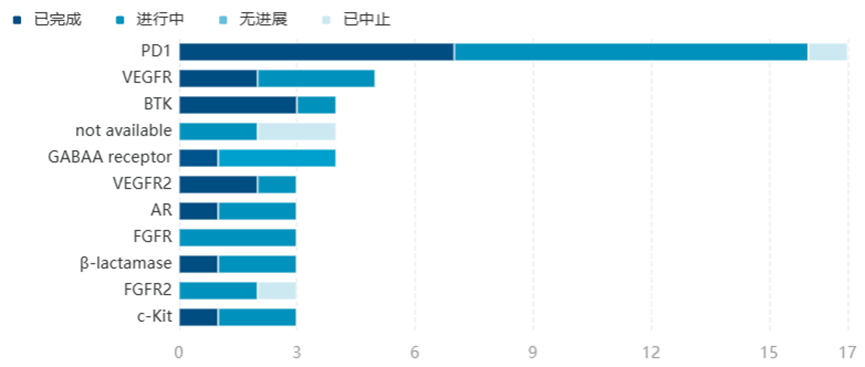
开展美国注册性III期临床的中国创新药靶点分布
目前,国内已有11款PD-1抗体(包括卡度尼利单抗在内)获批上市,替雷利珠单抗、卡瑞利珠单抗、信迪利单抗和特瑞普利单抗4款国产PD-1单抗已经占据全国PD-1药物市场70%的份额,不仅其它同类产品的国内市场空间十分有限,这4款第一梯队的PD-1产品也是要和更多进口PD-1/PD-L1产品一起进行存量竞争,因此必须走向更广阔的国际市场才能突破当前的商业化困境。
不管是被迫还是主动,中国创新药既然选择走出国门、开展国际化III期临床研究,也就意味着是要在国际成熟药品市场的规则下参与这场竞争游戏。想在现有的市场格局上抢走蛋糕,就要用令人信服的临床数据结果说话,因此一些对比临床标准疗法或经典药物的试验日益增多,这一点国际和国内市场都是如此(见:中国创新药需要“头铁”玩家)。
贝达药业的恩莎替尼应该是第一个开展头对头、全球III期临床的国产创新药,并且相比同类产品克唑替尼取得了优效,恩莎替尼和泽布替尼先后打败明星产品的真实案例也能在一定程度上鼓舞了国内药企征战海外的信心。中国药企国际III期头对头研究结果
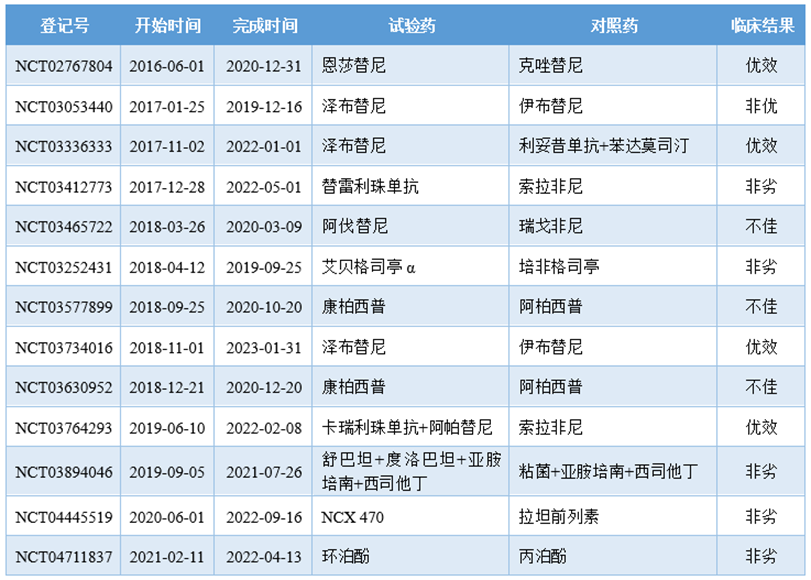
注:试验地区以美国为主。
头对头研究数量上的增加是中国创新药期望自证实力的标志,研究终点上的细微变化也同样显露着中国药企坚持创新以及与国际接轨的希冀和努力。这一点在肿瘤领域有很好的体现。非小细胞肺癌(NSCLC)是大部分抗肿瘤药物的主阵地。目前,至少有9项由中国药企牵头的针对NSCLC的重磅III期头对头研究正在进行中。
其中,被挑战的对象包括奥希替尼、替雷利珠单抗、帕博利珠单抗和阿替利珠单抗,而研究所设置的主要终点不外乎无进展生存期(PFS)、总生存期(OS)、PFS & OS三种情况。NSCLC领域的部分重磅III期头对头研究
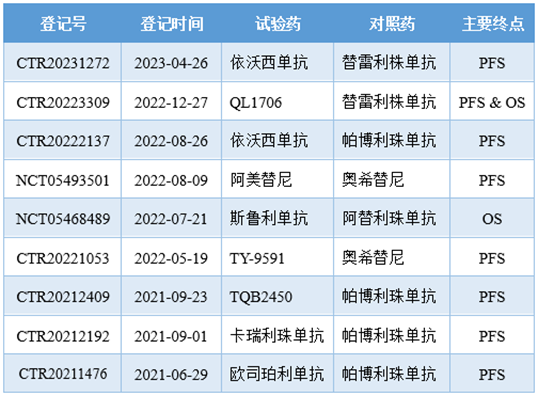
在抗肿瘤药物的临床试验中,主要终点的选择通常需要考虑癌症类型、治疗手段、预后、方便性等多方面的因素。对于NSCLC来说,治疗手段已经很多,精准治疗模式也日趋成熟,患者的生存期和生存率得到了一定程度的改善。但是,患者仍然需要更长的生存时间。
相比于随访时间相对更短且测量过程更为麻烦的PFS,考察OS更能代表研究性药物对患者的临床获益。此外,PFS获益并不能100%转化为OS获益。因此,FDA更倾向于企业将OS设计为评估抗肿瘤药物疗效的主要终点。
以OS为主要终点,往往意味着需要更多的入组患者、更长的随访时间、更高的研究成本以及更高的失败风险(易受交叉治疗和后续治疗的影响)。所以,主要终点的选择是可以在一定程度上彰显一家企业的魄力以及对自己产品的信心的,当然,也需要监管机构的监督。其实最根本的策略还是要以人为本,真正做到以患者为中心,如此才能带来有价值的创新。
我们已经可以看到,不断地有中国企业走出去开展国际多中心临床或者挑战实力强的“海外选手”,这些都是中国创新力量持续壮大的见证,也是中国药企力求参与国际竞争的行动力的体现。
虽然最终结果不一定是积极的,例如北极星药业、和黄医药、康弘药业等公司皆在海外注册性III期临床中遭遇挫折,但不管怎样,有所尝试并从中吸取很多经验才能有更多的研发实力提升。期待未来可以看到越来越多的中国创新药走出国门,闪耀国际舞台。

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 33
33

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 35
35

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 35
35