 产业资讯
产业资讯
 药融圈
药融圈  2023-08-18
2023-08-18
 4429
4429
2023年8月11日,荃信生物与华东医药合作开发的乌司奴单抗(原研喜达诺®)生物类似药QX001S申报BLA获NMPA受理,适应症为银屑病。QX001S有望成为国内首款获批的乌司奴单抗生物类似药。乌司奴单抗原研药于2009年获得FDA批准,2017年国内获批,是针对性抑制IL-23及IL-12通路的首款生物药,也是全球治疗银屑病的主要疗法之一。2022年全球销售额高达97.23亿美元,2023上半年销售额达52亿美元,有望在今年成为百亿美元品种。QX001S的上市或将率先打破乌司奴单抗原研品种在国内市场一家独大的销售格局,给病患提供更可及的国产替代选择。
银屑病(Ps)俗称“牛皮癣”,是一种免疫介导的慢性、复发性、炎症性、系统性疾病,临床表现为鳞屑性红斑或斑块,局限或广泛分布,且无法治愈,严重影响患者生活质量。其发病机制复杂,至今尚未完全阐明,故其治疗目标是控制病情进展,减少复发,从目前的症状控制过渡到达标治疗。
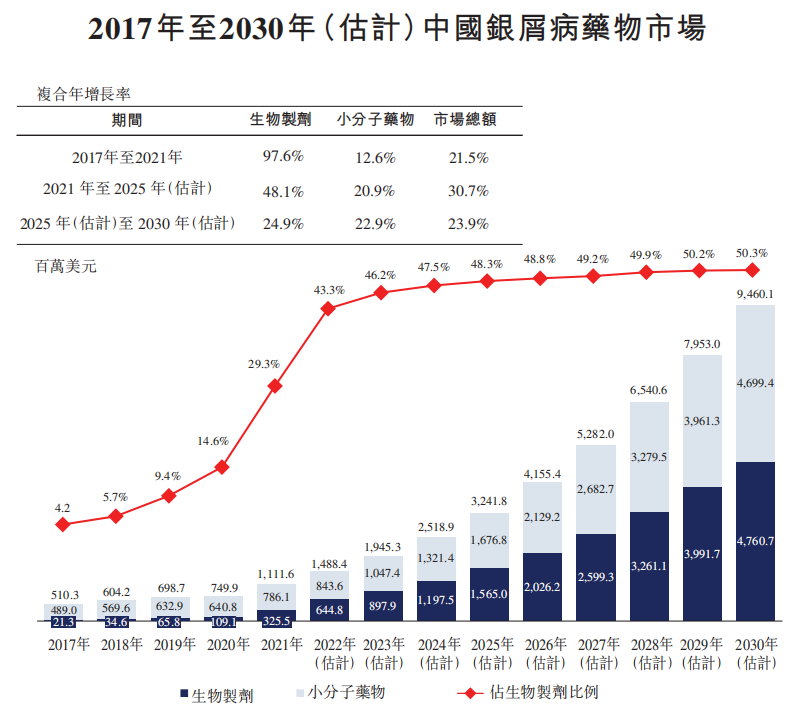
根据弗若斯特沙利文的资料,2021年中国银屑病的患病人数为670万人,预计于2030年将达到690万,其中20%至30%的患者为中重度银屑病。2021年,中国的银屑病药物市场规模为11亿美元,预计于2030年将增长至95亿美元,复合年增长率为27.1%。其中,生物药2021年市场占有率为29.3%,随着国内庞大的患者群体和临床治疗需求,以及新药的不断进入,估计于2030年将上升至50.3%,市场前景广阔。
《中国银屑病诊疗指南(2023版)》指出,银屑病治疗目的主要在于实现症状和皮损的完全清除或几乎完全清除。不同症状的患者应选择规范、安全、个体化的治疗方案。对于轻度银屑病患者,常用外用药物治疗,如维生素D3衍生物和糖皮质激素等,但长期使用会引起局部不良反应,而对于广泛皮癣患者来说,可能会带来不便,并且患者的依从性存在显著差异。非甾体抗炎药(NSAID)及改善病情抗风湿药(DMARD)也常用于控制银屑病及缓解疼痛、僵硬及肿胀等症状,但与靶向生物药相比,NSAID及DMARD的疗效有限。
一项纳入8767例中国银屑病患者的前瞻性队列研究表明,与光疗、外用药物等传统疗法,以及环孢素、甲氨蝶呤、阿维A等系统性治疗药物相比,靶向生物药在治疗中重度银屑病患者中表现出更大程度的预后改善。
目前,IL抑制剂已成为中重度银屑病治疗的首要选择。一项比较非生物全身制剂、小分子制剂和生物制剂对中度至重度银屑病患者的利与弊的网状Meta分析显示,多款IL-17抗体和IL-23抗体达到PASI 90的可能性明显高于TNFα抗体。另一方面,TNF抑制剂主要市场集中于类风湿性关节炎(RA)和强直性脊柱炎(AS),并非治疗银屑病的优选。
IL(白细胞介素)在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化及在炎症反应中起重要作用。在Th17通路中,主要靶点包括IL-17A及IL-23,而由于IL-23在银屑病发病机制中处于IL-17的上游,靶向IL-23(包括IL-12/23)通路可实现更深和更持久的炎症缓解,在临床研究中显示出优越的疗效及安全性。
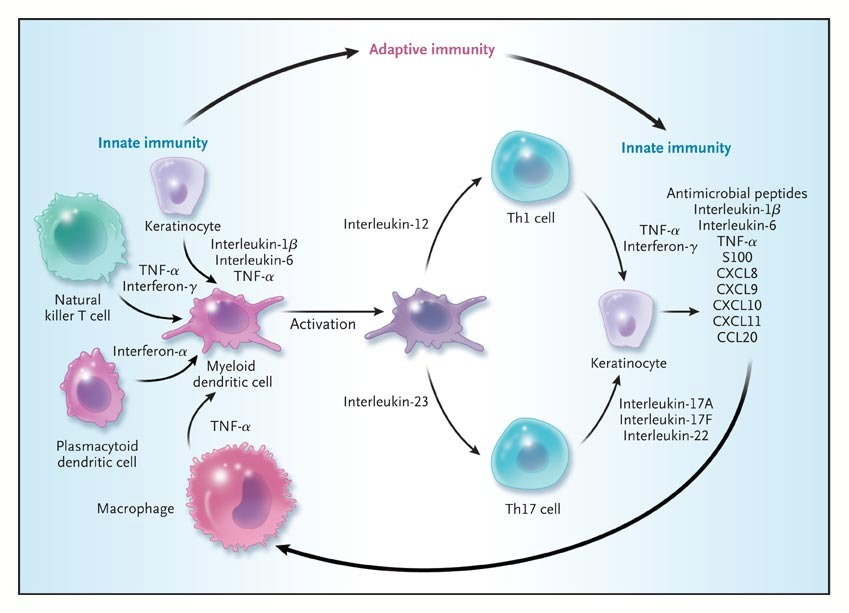
▲图源:NEJM
由于银屑病的病程漫长、易复发,药物的长期疗效与安全性就显得尤其重要。国际银屑病共识认为,药物留存率作为银屑病的治疗目标之一,可以很好地反映药物的安全性、有效性及依从性。在这一方面,靶向IL-12/23的生物制剂已在丹麦、斯洛文尼亚及日本等国家的多项真实世界研究中显示出了优异的结果,与其他生物制剂相比,乌司奴单抗具有最高的药物留存率以及最好的安全性。

▲图源:Int J Dermatol
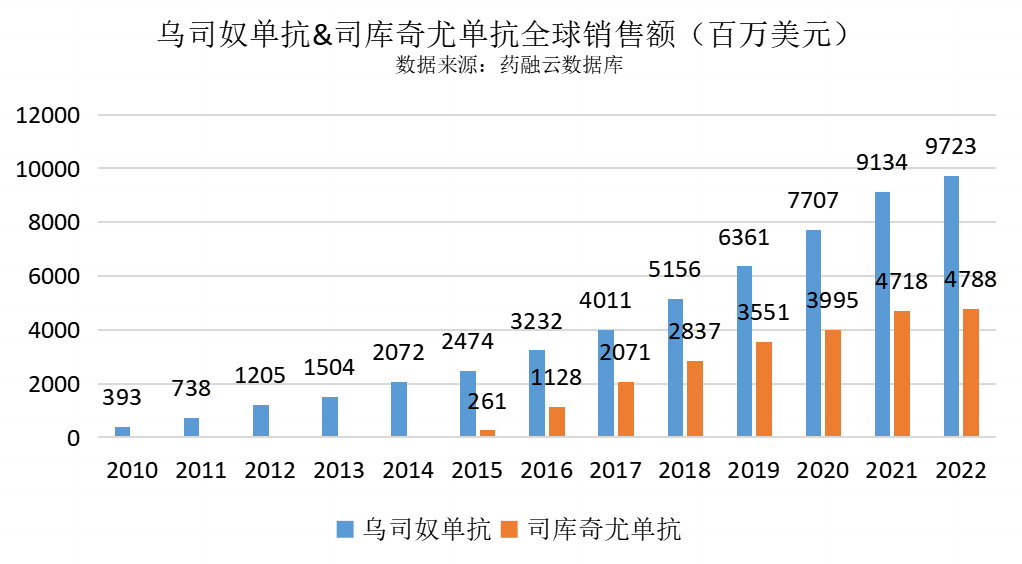
同时,从商业表现也可看出乌司奴单抗的临床治疗地位,下图显示,即使是在司库奇尤单抗(Cosentyx)销售额快速放量的年份,乌司奴单抗依然保持稳健增长(增长也包括IBD适应症的销售贡献)。
▲药融圈内容团队制图
在疗效方面,IL-23通路的长期获益优势也显露无疑。2020年1月,艾伯维宣布其IL-23抑制剂瑞莎珠单抗(Skyrizi)在治疗斑块型银屑病的头对头3期临床研究中,击败了诺华的司库奇尤单抗达到了主要终点和全部次要终点。早在2018年9月完成的ECLIPSE试验也显示古塞奇尤单抗(Tremfya)在长期疗效方面头对头优于司库奇尤单抗。
更优的疗效和给药便利性让IL-23抑制剂在银屑病治疗领域大放异彩,国际上已经出现IL-23抑制剂超越IL-17抑制剂的趋势。司库奇尤单抗2022年全球销售额已至瓶颈(2022年47.88亿美元Vs 2021年47.18亿美元),2023年上半年更呈现负增长;反观IL-23抑制剂,瑞莎珠单抗2022年全球销售额较2021年接近翻倍,达51.65亿美元,古塞奇尤单抗虽晚于依奇珠单抗一年上市,但2022年销售额仍实现了超越(26.68亿美元Vs 24.82亿美元)。国际上,银屑病患者的维持治疗已逐步转移到长期疗效和安全性更佳的IL-23抑制剂;而国内市场由于其他生物制剂的可及性或依从性相对较差,司库奇尤单抗近两年“几无敌手”,但随着IL-23靶点产品逐渐丰富,国际市场的发展脉络有望在国内重演。
目前,国内获批了三款治疗银屑病的IL-12/23抑制剂或IL-23抑制剂,除了今年5月刚获批的替瑞奇珠单抗之外,乌司奴单抗及古塞奇尤单抗分别于2022年及2023年医保生效,其中乌司奴单抗已明显放量,公开信息显示,2022年中国市场喜达诺®(乌司奴单抗)销售额超过9.5亿元,其中,于公立医疗机构实现10倍增长。QX001S则有望在乌司奴单抗生物类似药中取得先发优势。
在国内,QX001S未来的商业化将由荃信生物与华东医药合作进行。华东医药是一家在慢性病管理方面经验丰富且在自身免疫及过敏性药物方面拥有强大销售网络的知名老牌药企,这与荃信生物的产品布局十分契合,而且华东医药在自免疾病领域已拥有生物药和小分子创新产品10余款,管线协同效应明显,此次与荃信生物合作的QX001S(HDM3001)若能顺利获批,将进一步深化华东医药在自免领域的布局。
荃信生物作为此前尚未有药品商业化经验的biotech,建立庞大商业化团队将耗时且昂贵,因此战略性地选择与知名企业建立合作,能够更加快速且经济高效地将候选产品商业化,同时也使得荃信生物能够更专注于自身创新药产品管线的发展。借助华东医药的销售渠道建立商业化优势,QX001S有望快速获得市场份额,前景可期。
作为荃信生物2015年成立后布局的首个产品,乌司奴单抗相对当时的阿达木单抗可谓“名不见经传”,但就现有研发格局,荃信无疑避开了一个竞争更为剧烈的单品领域。药融云数据显示,截至目前,乌司奴单抗生物类似药国内在研企业一共3家,而阿达木单抗在国内已有7款生物类似药获批上市,另有至少3家已进入3期临床阶段。此外,以乌司奴单抗切入银屑病为代表的皮科领域,也体现了荃信的商业可行性思维。相较于国内已经放量的司库奇尤单抗,乌司奴单抗拥有更好的用药依从性(100kg体重以下一年仅需4针)及更低的给药剂量(维持治疗期年度抗体用量仅为180mg),相对于司库奇尤单抗一年12次且单次300mg给药量优势巨大,将成为银屑病生物制剂领域的强有力竞争者。
除了靶向IL-12/23的乌司奴单抗生物类似药QX001S,荃信生物还拥有靶向IL-23的创新药QX004N,仿创结合,可全面解决银屑病患者治疗需求。在临床前研究中,QX004N显示出良好安全性以及与瑞莎珠单抗相似的功能效力,目前正在国内开展QX004N用于治疗银屑病的Ib期临床试验。IL-23抑制剂作为目前可以预期的银屑病“最优解决方案”,抢滩布局的国内企业并不多,而荃信在已有乌司奴单抗生物类似药针对银屑病的情况下,仍然坚定布局IL-23生物制剂,也能窥见其在自免领域的一些独特思考。
此外,药融圈注意到荃信生物公司网站还披露了其在研的针对特应性皮炎、结节性痒疹的IL-4Ra抗体QX005N,针对瘙痒症的IL-31R抗体QX010N,以及针对慢性自发性荨麻疹(CSU)的c-kit抗体QX013N,这些资产也进一步体现了荃信在皮肤科领域深化布局的决心。
炎症性皮肤疾病在国内患者群体庞大,除前文提及的银屑病外,预计2030年特应性皮炎患者将达8130万人,其中30%患有中重度疾病,而无获批准生物疗法的结节性痒疹患者预期将达210万人,皮科领域存在巨大的医疗需求缺口。
通过最初的QX001S、QX005N和QX004N,再到QX010N和QX013N等产品,荃信已经逐步建立起皮科大适应症的全方位布局,且随着在皮肤科领域的临床资源的不断拓展,荃信有可能编织出自主掌握的医院资源网络,为皮肤科领域的深化研究,乃至后续的商业化打下扎实而稳健的基础,其也有望打造出一个基于皮肤科全生命周期及全病种管理的皮肤科品牌。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考资料
药融云数据库https://pharma.bcpmdata.com/;
中华医学会皮肤性病学分会银屑病专业委员会. 中国银屑病诊疗指南(2023版)[J].中华皮肤科杂志,2023, 56(7):573-625. doi:10.35541/cjd.20220839;
朱雨雨, 宋承霖, 孙洋. 银屑病发病机制及药物调控研究进展. 药学学报, 2020, 55(7): 1393-1400.;
Sbidian E, Chaimani A, Guelimi R, et al. Systemic pharmacological treatments for chronic plaque psoriasis: a network meta-analysis. Cochrane Database Syst Rev. 2023;7(7):CD011535. Published 2023 Jul 12. doi:10.1002/14651858.CD011535.pub6;
Yang Z, Han S, Wu P, et al. Modeling Posttreatment Prognosis of Skin Lesions in Patients With Psoriasis in China. JAMA Netw Open. 2023;6(4):e236795. Published 2023 Apr 3. doi:10.1001/jamanetworkopen.2023.6795;
Nestle FO, Kaplan DH, Barker J. Psoriasis. N Engl J Med. 2009;361(5):496-509. doi:10.1056/NEJMra0804595;
Gao L, Li Q, Zhang H, et al. A Biosimilarity Study Between QX001S and Ustekinumab in Healthy Chinese Male Subjects. Front Pharmacol. 2021;12:675358. Published 2021 May 18. doi:10.3389/fphar.2021.675358;
Lunder T, Zorko MS, Kolar NK, et al. Drug survival of biological therapy is showing class effect: updated results from Slovenian National Registry of psoriasis. Int J Dermatol. 2019;58(6):631-641. doi:10.1111/ijd.14429;
https://news.abbvie.com/news/press-releases/new-head-to-head-phase-3-data-show-skyrizi-risankizumab-superior-to-cosentyx-secukinumab-across-primary-and-all-ranked-secondary-endpoints-in-adults-with-moderate-to-severe-plaque-psoriasis-at-52-weeks.htm;
荃信生物招股书、企业官网等等。

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-10-13
2025-10-13
 62
62

 产业资讯
产业资讯
 药研网
药研网  2025-10-13
2025-10-13
 58
58

 产业资讯
产业资讯
 医药魔方Info
医药魔方Info  2025-10-13
2025-10-13
 52
52