 产业资讯
产业资讯
 药明康德
药明康德  2023-11-02
2023-11-02
 1847
1847
根据PDUFA的预期目标日期,预计11月,美国FDA将对8款创新药物或疫苗的批准做出监管决定,本文将对这些疗法或疫苗进行相关介绍。
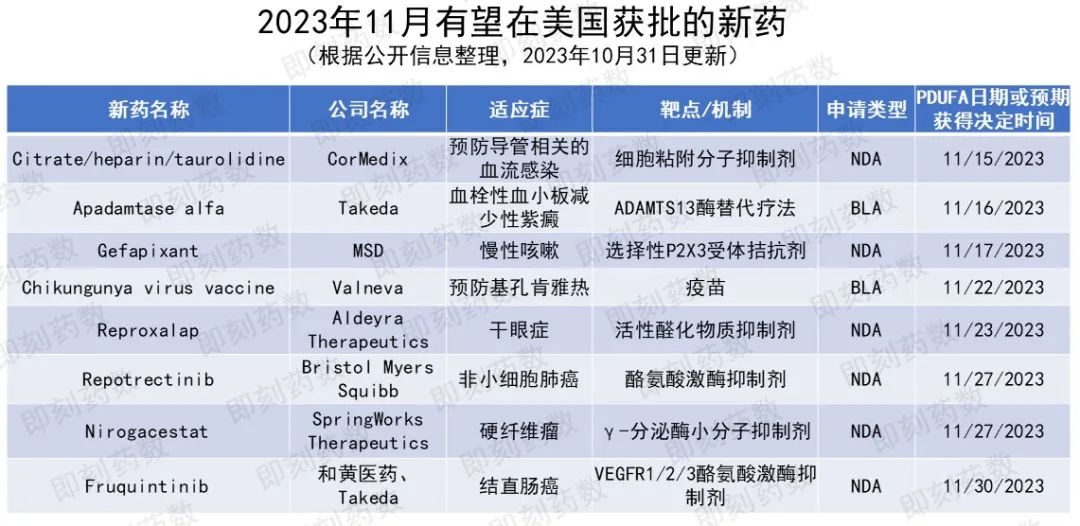
▲11月美国FDA可能批准的新药(药明康德内容团队制图)
活性成分:taurolidine
适应症:预防导管相关血流感染(CRBSI)
公司名称:CorMedix
CRBSI是使用中心静脉导管(CVC)进行血液透析(HD)的一种可预防的并发症,其长期并发症导致的发病率和死亡率都很高。尽管二十年来采取了许多改善肾脏健康的措施,但采用CVC-HD的肾衰竭患者发生CRBSI的风险仍在增加。一项纳入了超过5万名采用CVC-HD的患者的回顾性研究结果显示,约33%的的患者会出现CRBSI。
CorMedix的主打在研疗法DefenCath的关键成分是taurolidine,这是一种从天然氨基酸牛磺酸衍生的人工合成广谱抗菌和抗真菌药物,具有抗炎和潜在的抗肿瘤活性。Taurolidine除了能够破坏细胞壁并破坏细菌菌毛,还可以结合并中和细菌外毒素和内毒素(例如脂多糖,LPS)。含有taurolidine的产品已在欧洲上市多年,迄今为止,尚未出现细菌对其产生耐药性的情况。
此前,DefenCath获得了FDA授予的快速通道资格和合格传染病产品(QIDP)资格,最初的新药申请(NDA)获得了优先审评资格,以表彰其解决未竟医疗需求的潜力。一项大型3期临床研究的结果表明,DefenCath可以将接受CVC-HD患者的CRBSI的发生率降低约71%,并具有良好的安全性。
活性成分:apadamtase alfa
适应症:先天性血栓性血小板减少性紫癜(cTTP)
公司名称:武田(Takeda)
cTTP是一种罕见的慢性凝血疾病,发病原因是由于ADAMTS13酶的缺失,导致血管性血友病因子(VWF)多聚体在血液中积累。这些VWF多聚体的积累导致血小板的聚集和粘连,造成小血管中异常凝血,并出现溶血性贫血和血小板减少症。急性TTP如果没有接受治疗,患者死亡率超过90%。
TAK-755是首款处于临床开发阶段的重组ADAMTS13蛋白(apadamtase alfa),可以替代缺失或功能失常的ADAMTS13酶。该候选疗法获得了FDA的快速通道资格和孤儿药资格,并在今年5月获得了FDA的优先审评资格,用于预防和治疗cTTP。
今年9月公布的一项全球关键性3期临床试验的结果显示,没有患者在接受TAK-755预防性治疗期间发生急性TTP事件。与基于血浆的疗法相比,TAK-755还将血小板减少症的发生率降低了60%。血小板减少症是疾病活动的一个重要标志,也是最经常观察到的TTP表现。此外,TAK-755表现出了良好的安全性和耐受性,与基于血浆的疗法相比,具有潜在的安全性优势。接受TAK-755治疗的12-68岁的患者中,有10.3%的患者报告了治疗伴发不良反应(TEAEs),而接受基于血浆的疗法的患者中有50%报告了TEAEs。此外,一项3b期延续性研究的中期分析结果表明,TAK-755预防疗法的安全性始终良好,没有出现中和抗体。
活性成分:gefapixant
适应症:慢性咳嗽
公司名称:默沙东(MSD)
据默沙东新闻稿中的统计数据显示,慢性咳嗽(持续超过8周)的患病率占全球成年人的10%。在多达46%的病例中,尽管患者进行了彻底的检查,仍无法确定其疾病原因。目前,尚无已批准的慢性咳嗽疗法出现。
Gefapixant是一种口服选择性P2X3受体拮抗剂。P2X3受体的过度活化与感觉神经元的超敏化(hyper-sensitization)有关。损伤或感染引发的气道和肺部神经元超敏反应可引起过度,持续和频繁的咳嗽。日本厚生劳动省于2022年批准了gefapixant(商品名:Lyfnua)45 mg片剂的上市申请,用于治疗患有难治性或不明原因的慢性咳嗽的成年患者。
此前,默沙东宣布gefapixant在治疗顽固性或无法解释的慢性咳嗽成人患者的两项关键性3期临床试验COUGH-1和COUGH-2中达到主要疗效终点。与安慰剂相比,gefapixant能显著减少患者的咳嗽频率。
活性成分:Chikungunya virus vaccine
适应症:预防基孔肯雅热
公司名称:Valneva
基孔肯雅热是一种蚊子传播的病毒性疾病,由基孔肯雅病毒(CHIKV)引起,通过伊蚊传播,该病毒感染会导致72-92%的人在被蚊子叮咬后的4-7天内出现症状性疾病。虽然CHIKV感染的死亡率很低,但发病率却很高,但目前还没有基孔肯雅热的预防性疫苗或有效的治疗方法。
VLA1553是一种针对CHIKV的在研、单次注射的活体病毒减毒候选疫苗。它是通过删除CHIKV基因组的一部分而设计的。VLA1553在2018年、2021年和2023年分别获得了FDA授予的快速通道资格、突破性疗法认定和优先审评资格。
今年6月发布在《柳叶刀》杂志上的关键性3期临床试验结果显示,受试者在单次接种VLA1553疫苗28天后表现出非常高的血清反应率,达到98.9%。这种免疫原性在年轻人和老年人中都相似,96%的参与者在接种疫苗后6个月时仍保持血清反应。VLA1553总体上是安全的,在年轻人和老年人中的耐受性均良好。
活性成分:reproxalap
适应症:干眼症(dry eye disease)
公司名称:Aldeyra Therapeutics
干眼症是一项常见的炎症疾病,预估影响美国约3900万人。此疾病是由于眼睛前侧表面不够湿润及缺乏润滑,造成眼睛干涩、发炎、疼痛、不适、刺激以及生活品质的下降,在严重的情形,甚至会造成永久性的视力损伤。许多医生与病患普遍认为现有的干眼症疗法不足以完全控制症状,许多疗法需要数周或数月才可见效果。
Reproxalap是一款有潜力成为“first-in-class”的在研小分子活性醛化物质抑制剂。活性醛化物质含量会在眼部或系统性发炎时上升,造成眼睛发炎、泪水分泌降低、眼睛发红以及改变泪水内脂质组成,许多干眼症患者具有较高的活性醛化物质含量。
在去年所公布的试验结果显示,病患在接受一天的reproxalap(0.25%)治疗后,其在试验的两项主要终点,即在干燥眼房(dry eye chamber)中的眼睛发红情形与Schirmer测试上,都在统计学上显著优于载体对照组。值得注意的是,当接受reproxalap治疗的患者进入干燥眼房仅10分钟后,与载体组相较,患者在统计上显著减少眼睛发红,此现象一直持续到最后一个测量的时间点(90分钟)。而Schirmer测试则是在患者接受第4剂药品的前后10分钟进行,而在这两个时间点上,reproxalap组的表现都明显优于对照组。Reproxalap目前已在超过2000位患者进行测试,并展现良好的耐受性与安全性,没有观察到临床上显著的安全性问题,轻微、暂时的滴注处刺激是临床试验中最常见的不良反应。
活性成分:瑞普替尼(repotrectinib)
适应症:非小细胞肺癌(NSCLC)
公司名称:百时美施贵宝(Bristol Myers Squibb)
瑞普替尼是Turning Point公司(现已被百时美施贵宝收购)开发的一款ROS1和NTRK靶向抑制剂。它具有独特的结构,与靶点蛋白的结合位点位于“ATP口袋”内,并且不受多种耐药性突变的影响。因此,它能够克服多种对其它TKI产生抗性的基因突变,杀死携带ROS1或NTRK基因融合的多种肿瘤细胞,有潜力治疗ROS1阳性的NSCLC,以及ROS1、NTRK和ALK阳性的实体瘤。
2020年7月,再鼎医药宣布与Turning Point公司达成合作,获得瑞普替尼在大中华区的独家开发及商业化权。根据协议条款,Turning Point公司将获得2500万美元的现金预付款,最高至1.51亿美元的潜在里程碑付款等。2022年6月,百时美施贵宝公司宣布与Turning Point公司达成协议,将斥资超过40亿美元收购后者,从而将瑞普替尼纳入其研发管线。
此前,瑞普替尼治疗ROS1阳性晚期非小细胞肺癌的全球1/2期注册性TRIDENT-1研究已在4个患者队列中均获得积极顶线结果。根据今年8月发布的TRIDENT-1注册性研究的最新结果,瑞普替尼表现出对TKI初治患者和既往接受过一种TKI且未接受过化疗的患者在内的ROS1阳性NSCLC患者具有持久疗效,包括颅内活性。在中位随访时间为24个月的TKI初治患者(n=71)中,基于独立盲法中心评估(BICR)确认的客观缓解率(ORR)为79%,中位缓解持续时间(DOR)为34.1个月,中位无进展生存期(PFS)为35.7个月。在基线时可测量脑转移的患者(n=9)中,基于BICR的颅内ORR为89%,且缓解时间延长。
在中位随访时间为21.5个月、此前接受过一种TKI且未接受过化疗的患者(n=56)中,基于BICR确认的客观缓解率为38%,中位DOR为14.8个月,中位PFS为9.0个月。在基线时可测量脑转移的患者(n=13)中,基于BICR的颅内ORR为38%。在2期推荐剂量下,瑞普替尼的安全性是可控的,并且与之前的报告一致。
活性成分:nirogacestat
适应症:硬纤维瘤
公司名称:SpringWorks Therapeutics
硬纤维瘤是一种失能性并可导致毁容的罕见软组织肿瘤。它可能快速侵袭周围的健康组织,造成严重疼痛,内出血,动作范围受限,甚至死亡。历史上,硬纤维瘤的治疗方法为手术切除,然而在手术切除后肿瘤复发率非常高,导致疗效不佳。目前没有获批疗法治疗硬纤维瘤。
Nirogacestat是一款口服特异性γ-分泌酶小分子抑制剂。γ-分泌酶能够切割多种跨膜蛋白复合体,其中包括Notch蛋白。而Notch蛋白被认为能够激活导致硬纤维瘤生长的信号通路。
去年发布的一项随机双盲、含安慰剂对照的3期临床试验结果显示,nirogacestat治疗显著改善无进展生存期(HR=0.29,95% CI:0.15,0.55,p<0.001)。而且,临床试验达到所有关键次要终点,包括显著改善了疾病进展的硬纤维瘤患者的ORR和患者报告结果,同时,患者的疾病进展风险降低71%。
安全性方面,nirogacestat耐受性良好,安全性可控。大部分具有生育能力的女性出现与卵巢功能失常一致的不良事件。其它不良事件与此前报告的数据一致。
活性成分:呋喹替尼(fruquintinib)
适应症:结直肠癌
公司名称:和黄医药
结直肠癌是始于结肠或直肠的癌症。尽管早期结直肠癌能够通过手术切除,但转移性结直肠癌目前治疗结果不佳且治疗方案有限,仍然存在大量未被满足的医疗需求。虽然部分转移性结直肠癌患者或可受益于基于分子特征的个体化治疗策略,然而大部分患者未携带可作为治疗靶点的突变。
呋喹替尼是一种高选择性、强效的口服VEGFR-1、-2及-3抑制剂,其设计使其激酶选择性更高,旨在尽可能地降低脱靶毒性、改善耐受性及对靶点提供更稳定的覆盖。该产品通过抑制血管内皮细胞表面的VEGFR磷酸化及下游信号转导,抑制血管内皮细胞的增殖、迁移和管腔形成,从而抑制肿瘤新生血管的形成,最终发挥肿瘤生长抑制效应。
2023年3月,武田与和黄医药达成独家许可协议,在除中国大陆、香港和澳门以外的全球范围内进一步推进呋喹替尼的开发、商业化和生产。该药此前已于中国获批上市,用于既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者。
此前公布的3期临床试验结果显示,呋喹替尼在治疗经治转移性结直肠癌患者时展示出良好的疗效,患者在总生存期(OS)和PFS方面均达到具有统计学意义和临床意义的显著改善。呋喹替尼组患者的中位OS为9.3个月,较安慰剂组显著延长了2.7个月;此外,呋喹替尼组患者的中位PFS也显著延长了1.9个月,同时ORR和疾病控制率(DCR)也显著高于对照组。此外,呋喹替尼在患者中的耐受性普遍良好。

 产业资讯
产业资讯
 同写意
同写意  2025-10-01
2025-10-01
 48
48

 产业资讯
产业资讯
 辰小飞的log
辰小飞的log  2025-10-01
2025-10-01
 60
60

 产业资讯
产业资讯
 研发客
研发客  2025-10-01
2025-10-01
 52
52