 产业资讯
产业资讯
 医药魔方Pro
医药魔方Pro  2023-11-08
2023-11-08
 3328
3328
双特异性抗体是大分子领域的热门前沿赛道之一。根据医药魔方NextPharma数据库,双抗全球在研管线总数超出“大热”的ADC近40%(1102 vs. 797;数据截至2023-11-06)。
2022年以来,双抗药物在监管层面不断收获好消息。两年里,FDA批准了7款双抗上市,首款国产双抗(康方生物的卡度尼利单抗)也于2022年6月获NMPA批准。接二连三的监管喜讯下,双抗赛道焕发出新的光彩。
全球获批上市的代表性双特异性抗体
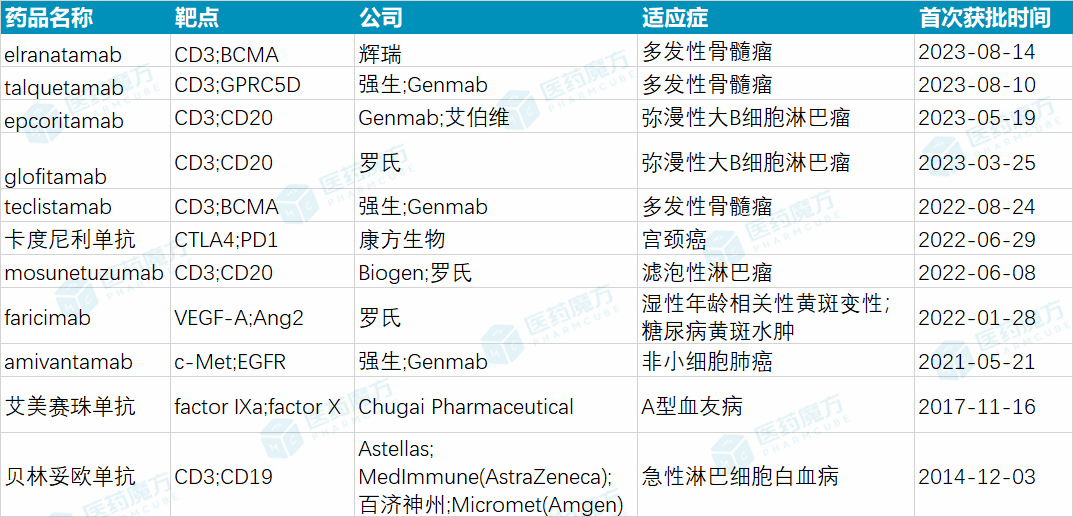
数据来源:医药魔方NextPharma;备注:2009年获欧盟批准上市的CD3/EpCAM双特异性抗体catumaxomab已退市。
FDA于2014年批准首款双抗上市,到2021年共批准了3款双抗药物,而过去两年,FDA连续批准了7款双抗分子,这究竟释放了怎样的信号?国内公司作为双抗研发的主力军(全球近五成双抗项目由国内公司开发),预计何时会进入“集中收获期”?市场空间如何?未来3-5年,双抗赛道的发展会有哪些新趋势?近日,针对这些热门话题,医药魔方Pro有幸采访到了维立志博创始人、总裁兼董事长康小强博士。
成立于2014年的维立志博在单抗和双抗研发方面已建立包含20多个肿瘤免疫治疗项目的丰富管线。2023年以来,维立志博在双抗开发方面取得了多项里程碑,包括GPRC5D/CD3双抗LBL-034中美获批临床、潜在first-in-class的治疗卵巢癌等恶性肿瘤的MUC16/CD3双抗LBL-033中美获批临床,且国内已完成首例受试者给药(LBL-033是国内首款获批开展临床试验的MUC16/CD3双特异性抗体)。
康小强博士表示:“监管机构的决定都是数据来说话,最近两年FDA新批的几乎都是CD3双抗,最大的感受就是CD3双抗经过多年的探索在血液瘤领域开始进入‘收获期’。当然,除了血液瘤,近几年CD3双抗在实体瘤中其实也取得了积极进展,预计未来3-5年CD3双抗在实体瘤治疗方面会有重要突破。”

康小强,维立志博创始人、总裁兼董事长。武汉大学医学院毕业,同济医科大学血液学硕士,美国北德克萨斯大学生物医学博士;美国NCI外科主任Steven Rosenberg实验室博士后肿瘤免疫治疗研究4年;美国ImClone Systems资深科学家兼资深课题组长从事抗体新药研发16年;参加Erbitux研发和上市,负责功能和机理研究。并且负责研发出一个肿瘤疫苗和多个抗癌抗体新药进入临床试验。2014年回国创办了南京维立志博生物科技有限公司。
突破瓶颈,打造CD3 Engager、4-1BB Engager双平台
医药魔方Pro:目前获批上市的11款双抗中,有7款是CD3双抗。维立志博的CD3 Engager有何差异点及优势?
康小强博士:CD3双抗开发有两大挑战需要克服,一个是细胞因子风暴副作用,另一个是过度刺激导致T细胞耗竭。针对这两大挑战,我们一方面是将CD3双抗与CD3的亲和力调节到“生理状态”,避免T细胞过度激活;另一方面,通过使用不同的双抗模板,我们的双抗与肿瘤抗原结合后,才会暴露CD3抗体激活CD3,实现了有条件激活(在缺乏肿瘤抗原时,我们的双抗与CD3的亲和力非常弱)。
医药魔方Pro:在维立志博的CD3 Engager管线中,治疗卵巢癌等恶性肿瘤的MUC16/CD3双抗LBL-033在今年先后于中美获批临床。据悉,LBL-033是国内首款获批开展临床试验的MUC16/CD3双特异性抗体,且在全球范围内处于领先位置。能否分享一下LBL-033的立项思考?
康小强博士:MUC16是一个很好的肿瘤相关抗原(TAA),特别是在卵巢癌上高度表达,同时在子宫内膜癌、胰腺癌、非小细胞肺癌和胃癌等多种恶性肿瘤中异常表达,参与免疫逃逸、肿瘤细胞增殖和转移等调控。
目前CD3双抗在血液瘤治疗方面已经取得了令人欣喜的突破,但在实体瘤方面仍待探索。卵巢癌组织相比其它实体瘤相对更加松散,是一种介于血液瘤和实体瘤之间的瘤种;此外,这类癌症的一个重要特点是肿瘤浸润T细胞相对较多。因此,我们认为卵巢癌这类特殊的“中间态”肿瘤可能是探索CD3双抗实体瘤应用的一个优先选择。
医药魔方Pro:目前全球只有维立志博、Regeneron等少数公司在开发MUC16双抗。针对这个靶点,之前有相关的小分子或者单抗研发吗?
康小强博士:针对MUC16,先前业界尝试过单抗和ADC研发。单抗方面,单独的ADCC作用可能不足;ADC方面,由于MUC16是一种高度糖基化的Ⅰ型跨膜蛋白,分子量非常大,因此不太利于内吞。
医药魔方Pro:除了CD3 Engager,维立志博还在开发4-1BB Engager。这两类双抗的作用机制有何不同?
康小强博士:T细胞的充分活化需要两种刺激信号的协同作用,包括作用于CD3/TCR复合物的第一刺激信号,以及作用于CD28或4-1BB等受体的共刺激信号。CD3双抗激活TCR,相当于T细胞的第一信号,使T细胞直接杀伤肿瘤。4-1BB双抗激活4-1BB这类第二信号,间接刺激T细胞增殖,分泌细胞因子,杀伤肿瘤。临床进展方面,CD3双抗已经有7款产品获批上市,4-1BB双抗暂无产品获批上市。从目前的临床数据来看,CD3双抗也要远远好于4-1BB双抗。从科学的角度,这两类双抗可能联合使用能起到协同增效的作用。
医药魔方Pro:相比CD3 Engager,4-1BB Engager最快的项目还处于临床II期。4-1BB Engager的开发有哪些挑战需要克服?
康小强博士:4-1BB单抗的开发已经有很多年的探索,这类免疫激动剂的一大挑战是有很强的肝脏毒性,因为肝脏髓样细胞表达4-1BB;此外,此前业界也探索了HER2/4-1BB等类型的双抗,但由于4-1BB是间接激活T细胞,因此相比CD3双抗,直接杀伤肿瘤的作用要“弱一些”。
维立志博的4-1BB双抗,一方面是实现了4-1BB在表达PD-L1的肿瘤中的条件性激活,避免了肝脏毒性,这也克服了前期PD-L1/4-1BB双抗开发剂量上不去的瓶颈;另一方面,我们选择了PD-L1作为第二靶点,所开发的PD-L1/4-1BB双抗同时具有PD-L1抗体的功能,可以使表达PD-1的T细胞功能恢复正常,发挥杀伤肿瘤的作用。LBL-024目前正在II期临床,当前的数据显示,安全性和有效性均超出预期。
医药魔方Pro:双抗开发,对于fast follow 和 first-in-class两种不同的策略,维立志博在立项时是如何把握的?
康小强博士:产品的竞争性,我们一直非常重视。具体到立项,维立志博不简单是做fast follow还是first-in-class的考虑,而是会评估我们的技术和产品是否具有科学性、能否克服当前产品的一些障碍和挑战,带来更好的治疗获益。比如我们最近在中国和美国同时获批临床的GPRC5D/CD3双抗LBL-034,尽管强生的同类双抗talquetamab已经在今年8月获FDA批准上市,但我们依然认为,基于独特的CD3平台,我们的产品具有潜在的优势;此外,正如前面所提到的,先前有很多公司做PD-L1/4-1BB双抗但是剂量上不去,我们认为自己有能力克服这一障碍,并且我们也真的做到了。
双抗开发迈向下一程,“靶点选择”是最大挑战之一
医药魔方Pro:目前FDA批准上市的10款双抗中,有7款是在最近两年内获批。您认为这释放了怎样的信号?
康小强博士:监管机构的决定都是数据来说话,最近两年FDA新批的几乎都是CD3双抗,最大的感受就是CD3双抗经过多年的探索,在血液瘤领域开始进入“收获期”。当然,除了血液瘤,近几年CD3双抗在实体瘤上其实也取得了一些积极进展,比如安进的CD3/DLL3双特异性抗体tarlatamab(处于III期临床)、再生元的CD3/MUC16双特异性抗体ubamatamab,预计未来3-5年CD3双抗在实体瘤领域会有重要突破。
医药魔方Pro:2023年以来,双抗领域有哪些令您印象深刻的进展?
康小强博士:我印象最深的进展,一个是强生用于治疗多发性骨髓瘤的CD3/GPRC5D双特异性抗体talquetamab获批。FDA是基于I/II期临床数据批准了这款first-in-class产品(ORR为73%左右)。去年8月,强生的CD3/BCMA双特异性抗体teclistamab也获FDA批准上市(同样治疗多发性骨髓瘤)。强生目前在开发talquetamab+teclistamab的联合疗法,早期数据显示ORR达到了96%,这给双抗开发指明了方向。
另一个印象深刻的双抗进展,还是来自强生。2021年5月,FDA也是基于I期临床数据加速批准了强生的EGFR/c-Met双特异性抗体amivantamab用于治疗铂类化疗后进展的EGFR外显子20插入突变的转移性非小细胞肺癌患者。这是FDA首次批准一款靶向不同肿瘤抗原的双特异性抗体,也代表了双抗药物在治疗实体瘤方面取得了里程碑突破。值得一提的是,今年9月,强生宣布,amivantamab的III期试验取得成功,为这种类型双抗的开发带来了更多的信心。从这款产品,我们也能感受到,即便是相同的靶点,双抗分子的设计空间还是非常大的,强生的这款产品经过巧妙的设计(调节了分子对EGFR和c-Met的亲和力)具备了非常强大的内吞能力,同时能够产生ADCC效应。
医药魔方Pro:之前退市的双抗Removab,有人认为一个重要原因在于,最初的Removab工艺不够完善,导致双抗制药成本过高、产能过低,大规模商业化困难。当前,双抗研发的关键挑战有哪些?生产工艺/CMC是其中之一吗?
康小强博士:生产工艺/CMC已经进步很多,但还是要具体看双抗的结构,如对称,还是非对称,难度各不相同,但总体来说,工艺方面的挑战都是可以克服的。当前双抗开发最大的挑战,我认为是“靶点的选择”和“模板的选择”,前者决定了产品的科学性(背后的biology),后者一定程度上决定了产品的成药性。另外,再具体一些的挑战包括对不同靶点亲和力的摸索、分子结构的稳定性、PK性质、ADA等。
医药魔方Pro:经过过去几年的发展,双抗的靶点选择逻辑有提升吗?
康小强博士:从三个不同类别的双抗来看:首先,IO类的双抗,大家还是比较愿意选择成药性得到验证的靶点组合,比如PD-1/CTLA-4、PD-1/VEGF-A、PD-1/LAG3……;其次,针对血液瘤的CD3类双抗开发,大家其实都比较关注同靶点CAR-T细胞疗法的进展,这两类疗法从原理上其实非常接近;此外,靶向治疗类双抗(如EGFR/c-Met双抗)开发方面,一方面是选择成药性经过验证的靶点,另一方面是寻找肿瘤上“互相帮助、功能互补”的靶点对,比如一个靶点被抑制后,另一个靶点会上调。整体来看,双抗的靶点选择在过去几年是摸索出一些逻辑出来的。
3-5年后,国产双抗将进入“集中收获期”
医药魔方Pro:国内公司是双抗研发的主力军,全球有近一半的项目由国内公司开发。您预计国产双抗何时会进入大规模“收获期”?市场空间如何?
康小强博士:目前国内有多个产品处于临床开发中后期,预计再过3-5年会进入集中收获期。市场空间方面,双抗种类多样,靶点组合丰富,面向巨大的未满足临床需求,且国内布局未形成“严重内卷”,结合未来经济的发展、支付能力的提高,整体还是很乐观的。
医药魔方Pro:展望未来3-5年,双抗赛道会有哪些新趋势?
康小强博士:首先,我认为会有越来越多的CD3双抗获批上市;其次,在实体瘤治疗方面,双抗会取得更多突破;此外,未来基于双抗的联合治疗会是一种趋势,包括双抗与单抗(如PD-1单抗)、双抗与双抗(如CD3双抗联合4-1BB双抗;CD3双抗联合CD3双抗)、双抗与ADC的联合,因为很多问题无法靠一款双抗来解决。
医药魔方Pro:未来3-5年,您给维立志博制定了怎样的发展目标?
康小强博士:新药研发公司的发展通常分为3个阶段,第一个是“临床前阶段”,需要3-5年的时间;第二个是“临床阶段”,也需要3-5年;第三个是“商业化阶段”。维立志博目前处于临床开发后期与商业化早期的节点,希望3-5年后,我们已经成功跨过这个节点,真正成为一家进入商业化阶段的公司。
参考资料:
[1]https://www.prnewswire.com/news-releases/us-fda-approves-talvey-talquetamab-tgvs-a-first-in-class-bispecific-therapy-for-the-treatment-of-patients-with-heavily-pretreated-multiple-myeloma-301897786.html
[2]https://www.fda.gov/news-events/press-announcements/fda-approves-first-targeted-therapy-subset-non-small-cell-lung-cancer?utm_medium=email&utm_source=govdelivery
[3]https://www.janssen.com/phase-3-mariposa-2-study-meets-dual-primary-endpoint-resulting-statistically-significant-and

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 110
110

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 98
98

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 87
87