 产业资讯
产业资讯
 医药魔方
医药魔方  2023-11-10
2023-11-10
 3011
3011
2023年11月,第六届进博会如约而至。自从2018年以来,5年间进博会展现出强大的溢出效应,外资药企借助东风,加码对华投资,孵化创新企业,加速创新药品落地。
从上世纪90年代第一家外资药企落户浦东开始,外资药企与中国医药行业共同经历了30年激荡。今年是变化之年,外资药企既逢新机遇,又有新挑战,对进博会参与热情高涨。医药魔方直击进博现场,专访了多位外资药企高管,从研发、建厂、投资、孵化、产品不同纬度,解析外资药企未来在华布局趋势。
11月6日,全面恢复线下参展的第六届进博会上,展台人头攒动。
在7号馆医疗器械及医疗保健展区,进博会的“老朋友”——细胞治疗领域先行者复星凯特,今年也带着最新的成果前来展示,吸引了不少希望了解CAR-T细胞疗法新进展的观众。在去年的进博会上,复星凯特向大家展示了阿基仑赛(商品名奕凯达®)的临床研究、生产和商业创新成果,而这些成果在今年也取得了新进展。复星凯特此次展示的产品依然以这款CAR-T为主,这是复星凯特自美国Kite Pharma引进的CD19 CAR-T细胞治疗产品,已在中国获批用于复发或难治性大B细胞淋巴瘤(r/r LBCL)成人患者的治疗(包括一线免疫化疗无效或在一线免疫化疗后12个月内复发的成人大B细胞瘤患者,和既往接受二线或以上系统性治疗后的成人大B细胞瘤患者)。

“这次参加进博会,相信大家都怀着激动之心。企业方带来了很多全新、高水平的展示,观众的热情也比以往要高涨。”在复星凯特展台围观的人群前,复星凯特首席医学官(CMO)赵婧华博士表示。

复星凯特CMO赵婧华博士
负责血液肿瘤、实体肿瘤多个CAR-T产品及管线的临床开发与上市后医学推广。领导和撰写I-IV期临床研究方案及真实世界研究方案;带领临床运营团队积极推动C19拓展适应症的临床研究,以及新产品X19的上市前临床研究开展;带领医学科学团队推动奕凯达®二线治疗LBCL注册申请和实体瘤靶点临床概念验证研究;带领上市后医学团队推进多个IIT研究落地;并进行有效的药物警戒及风险管理。
产品“破圈“的下一站,是更广泛的受益人群
作为中国第一款上市的CAR-T,奕凯达®也引领了国内细胞及基因治疗(CGT)行业的快速发展。在这款产品首次获批后的2年间,CAR-T乃至整个细胞治疗领域都发生了很多变化。
在血液肿瘤及免疫领域扎根近20年的赵婧华对此也颇有感触。“大家对新技术的关注度更高了,而且能够感受到新技术对人类生命或生存质量所带来的革新性影响。这几天,不少观众来我们的展台了解CAR-T产品的制备全流程,当中一部分人还提出了一些相当专业的问题,这说明公众的知识储备和认知水平在明显提升。越来越多的人能够参与到创新技术和创新产品的交流互动中来,也是我们期待看到的现象。”根据医药魔方Nextpharma数据库的统计数据,全球在研CAR-T已超1500款,其中超过一半的产品来自中国药企。在这些产品中,靶点大户自然是奕凯达®所利用的CD19,但也出现了诸如MSLN(间皮素)、NKG2D(C型凝集素样受体)、CD70(CD27配体)这类还未经过充分验证的新兴靶点。
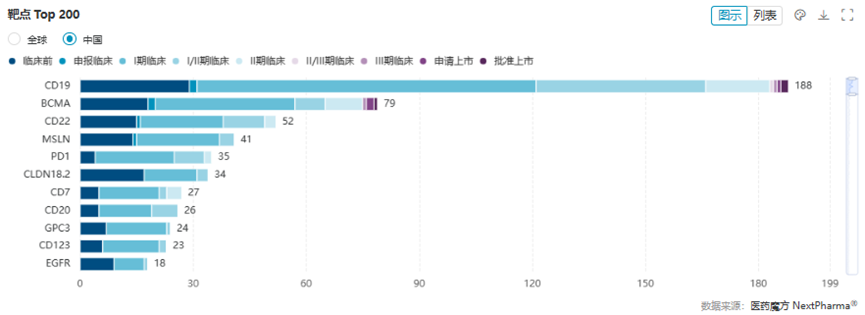
国内在研CAR-T细胞疗法TOP 11靶点CAR-T治疗又称为嵌合抗原受体T细胞治疗,相较于抗体、ADC、PROTAC等机制相对简单的药物类型,CAR-T产品需要经过非常复杂且精细的制备过程,尤其自体CAR-T产品,更是量身定做的“活”的药物。经过外周血采集、分离T细胞、活化T细胞、细胞转导、体外扩增、质控、回输等一系列步骤后,CAR-T才算完成从制备到治疗的完整流程。增强后的T细胞可以在患者体内持续杀伤肿瘤细胞甚至形成记忆性,这一特点也让CAR-T具备了癌症治愈潜力。
在细胞治疗界,众人皆熟知Emily的故事,这是举世瞩目的典型的从CAR-T治疗中受益的患者案例。2012年3月,年仅7岁的Emily加入了费城儿童医院进行的CAR-T细胞治疗免疫疗法临床试验,成为全球首位接受CAR-T技术治疗的白血病儿童患者,并在不久后顺利出院。CAR-T这一创新疗法正是宾夕法尼亚大学的Carl June教授和团队们开发的。而11年后的今天,18岁的Emily仍然健康快乐地活在这个世界上,并在今年顺利成为了宾夕法尼亚大学的一名新生。“这个故事非常振奋人心,CAR-T为Emily创造了崭新的生命状态,也为更多的肿瘤患者带来了能够正常生活、长生存的巨大希望。这也是我们尽最大努力去开发、去应用这类产品的原始驱动力,期待有更多像Emily一样的患者能通过CAR-T治疗得到治愈、获得新生。”赵婧华通过Emily的故事分享了对CAR-T治疗的愿景。在本届进博会上,复星凯特更新了奕凯达的治疗成果。自2021年6月获批到如今,这款产品已成功治疗超过600例淋巴瘤患者(包括临床试验中患者)。对ZUMA-1研究的长期随访数据显示,接受阿基仑赛治疗的LBCL患者,5年生存率达到了42.6%。而ZUMA-7研究的数据显示,与SOC(标准治疗)相比,阿基仑赛组患者的死亡风险降低了27%。今年6月,奕凯达®在国内新增获批二线治疗LBCL的适应症,有望惠及更多患者。奕凯达®新适应症的获批与其出色的全球临床数据和中国真实世界研究数据的完备度有着密不可分的关系。2022年4月,奕凯达®凭借其关键研究ZUMA-7中LBCL人群的优异疗效数据获FDA批准上市。在这项研究中,亚裔人群的占比为6%(22/359)。今年6月,奕凯达®在中国的首次大规模真实世界研究数据在欧洲血液年会(EHA)及世界恶性淋巴瘤大会(ICML)上公布并发表在《新英格兰医学》杂志上,核心结论是无论LBCL患者是否适合自体造血干细胞移植(ASCT),均可从奕凯达®治疗中获益。
中国证据越来越多,支付方式持续创新
“去年2月初,接受商业化奕凯达®治疗的患者已有近百例,但是真实世界研究中的病例却只有2例,极度缺乏证据积累,我为这个进度感到着急。” 赵婧华表示,作为新型的创新技术和产品,国家监管的要求也非常高,过少的病例研究不利于药物的安全性和有效性数据积累和证据生成,也会阻碍产品的新适应症推进,最终影响临床用药,损害患者利益。为了快速提升进度,在去年疫情期间,复星凯特团队与各中心的研究者们一起做了很多突破与努力,最终达成了可喜的结果,终于提前将101例患者的中期分析数据在国际大会上公布,这也是首次公开发布的、亚裔人群的、最大规模的、真实世界CAR-T研究数据。截至记者发稿日,该研究入组已经达到了198例,即将完成200例的入组目标。“我们正在加速最后几例的入组及接下来的数据清理与统计,期待明年可以在大型医学会议上展示更全面的中国人群数据。”临床上,CAR-T疗法的治疗端口前移也不断地在被研究者们探索中。阿基仑赛在一线治疗LBCL适应症上也取得了突破。II期ZUMA-12研究结果显示,一线高危LBCL患者在接受阿基仑赛治疗后,完全缓解率(CRR)达到了78%,客观缓解率(ORR)达到了89%。此外,患者报告的≥3级细胞因子释放综合征(CRS)和神经毒性事件发生比例也较低(8%和23%)。目前,复星凯特的合作伙伴美国凯特公司(吉利德旗下)正在开展阿基仑赛对比标准治疗(SOC)一线治疗高危LBCL患者的全球多中心III期ZUMA-23研究,而复星凯特也将紧跟全球进度,继续推进奕凯达®对LBCL治疗格局的重塑。此外,复星凯特已经在全力推进奕凯达®的另一项适应症,也就是用于复发难治滤泡性淋巴瘤(FL)的临床进度。CAR-T虽然有着治愈癌症的潜力,但由于昂贵的价格,一部分患者对其望而却步。为了让淋巴瘤患者尽可能应用奕凯达®,复星凯特在创新支付上也做了很多努力。到目前为止,奕凯达®已被纳入超过90款城市惠民保和超过60款商业保险,复星凯特也在全国25个省市建立了140多家奕凯达®高标准治疗中心。“由于自体CAR-T产品的特殊性,作为量身定做的“活”的药物,其生产成本远高于其它类型药物,因此需要持续探索创新的支付方式,并持续探索降低成本的可能性,这都需要全行业的共同努力与推进。”赵婧华指出。除了奕凯达®之外,复星凯特还开发了另一款CD19 CAR-T——FKC889(Brexu-cel),针对套细胞淋巴瘤(MCL)和B细胞性急性淋巴细胞白血病(B-ALL)。“目前两个研究都在中国桥接注册研究的患者招募阶段,我们希望能尽快推进其在中国注册上市,造福更多患者。”

 产业资讯
产业资讯
 医药财经
医药财经  2025-09-05
2025-09-05
 15
15

 产业资讯
产业资讯
 动脉网
动脉网  2025-09-05
2025-09-05
 14
14

 产业资讯
产业资讯
 新猎药人笔记
新猎药人笔记  2025-09-05
2025-09-05
 16
16