 产业资讯
产业资讯
 药明康德
药明康德  2023-12-01
2023-12-01
 1836
1836
根据PDUFA的预期目标日期,预计12月,美国FDA将对6款创新药物的批准做出监管决定,本文将对这些疗法进行相关介绍。

▲12月美国FDA可能批准的新药(药明康德内容团队制图)
活性成分:exagamglogene autotemcel(exa-cel)
适应症:严重镰刀型细胞贫血病(SCD)
公司名称:Vertex,CRISPR Therapeutics
Exa-cel是一款自体细胞疗法,它利用CRISPR/Cas9基因编辑系统,在体外对来自患者的造血干细胞进行编辑,使血红细胞生产高水平的胎儿血红蛋白(HbF)。HbF是携带氧气的血红蛋白的一种形式,在出生时自然存在,随着婴儿的长大,血液中的血红蛋白转换为成人形式的血红蛋白。通过exa-cel治疗,可以提高HbF水平,有可能缓解输血依赖性β地中海贫血(TDT)患者的输血需求,并减少镰刀型细胞贫血病患者的疼痛和使人衰弱的血管闭塞性危象。此前,exa-cel曾获FDA授予治疗镰刀型细胞贫血病和输血依赖性β地中海贫血的再生医学先进疗法认定、快速通道资格、孤儿药资格和罕见儿科疾病认定。本月它获得英国药品和健康产品管理局的有条件上市许可,商品名为Casgevy。
在治疗SCD和TDT患者的两项全球临床试验中,试验达到了各自的主要终点,即患者至少连续12个月没有发生重度VOC或不需进行输血。此前公布的临床试验结果显示exa-cel具有一次治疗,提供功能性治愈的潜力。
在接受治疗的44名TDT患者中,42名在随访时间为1.2-37.2个月时,不再需要接受输血,剩余两名患者接受的输血水平分别降低75%和89%。此外,所有31名接受治疗的严重SCD患者在随访时间为2.0-32.3个月时,均未出现血管闭塞性危象。
Exa-cel针对SCD和TDT的PDUFA日期分别为2023年12月8日和2024年3月30日。
活性成分:aprocitentan
适应症:难治性高血压
公司名称:Idorsia
Aprocitentan是一款靶向双重内皮素(endothelin)受体的口服拮抗剂。内皮素信息通路控制血管的收缩,被发现与高血压病变相关,在顽固性高血压患者中,此通路经常被激活,然而目前并没有抑制此通路的疗法。Aprocitentan除具潜力抑制内皮素通路外,其与其他药物产生药物间相互作用的机率低,这些特征都让aprocitentan具潜力成为治疗顽固性高血压患者的药物。
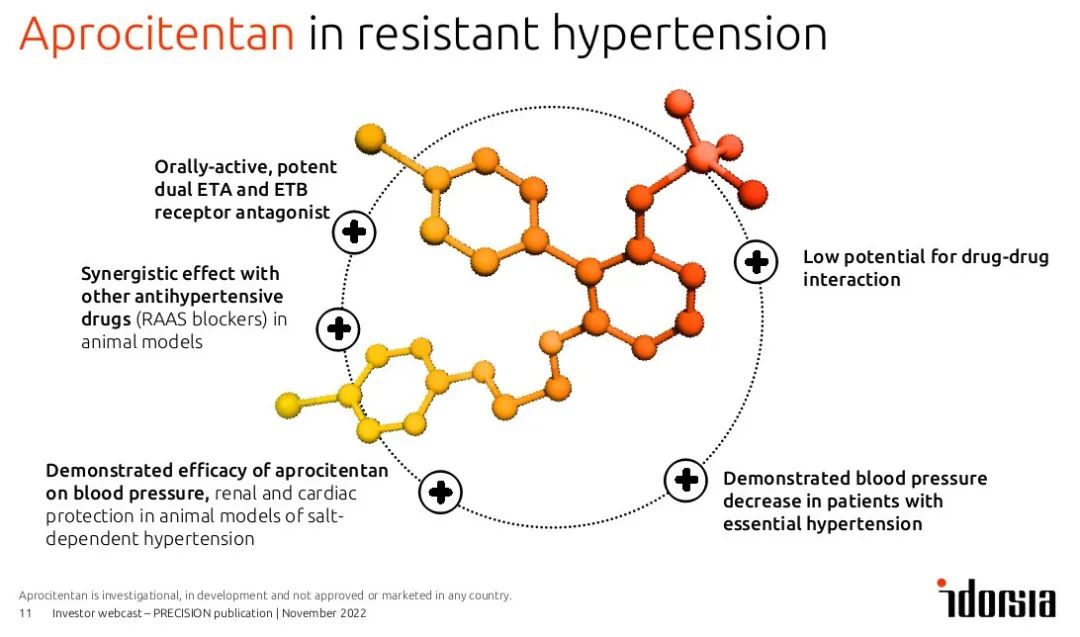
▲Aprocitentan的化学结构与效果(图片来源:参考资料[1])
NDA的递交主要包含PRECISION临床3期试验的结果,数据分析显示,当与其他高血压背景疗法联合使用时,aprocitentan可造成顽固性高血压患者血压在统计与临床上显著的下降,并维持长达48周。在试验中,此药物亦展现良好的耐受性。患者最常见的治疗伴发不良反应(TEAE)为轻中度的体内液体滞留(fluid retention),多属可控制情形。详细数据也发表在顶尖医学期刊《柳叶刀》上。
活性成分:lovotibeglogene autotemcel(lovo-cel)
适应症:镰刀型细胞贫血病
公司名称:bluebird bio
Lovo-cel是一种用于治疗SCD的一次性基因疗法,其设计目的是将改良形式的β-珠蛋白基因(βA-T87Q珠蛋白基因)的功能拷贝添加到患者自身的造血干细胞(HSCs)中。一旦患者具有βA-T87Q珠蛋白的基因,他们的红细胞可以产生能够抵抗血红细胞镰刀化的血红蛋白(HbAT87Q),目标是减少镰状红细胞、溶血和其他并发症。FDA此前已经授予lovo-cel孤儿药资格、快速通道资格、再生医学先进疗法认定(RMAT)和罕见儿科疾病认定。
该生物制品许可申请(BLA)的递交是基于HGB-206临床1/2期试验中C队列36名患者的疗效结果,中位随访时间为32个月,以及临床3期试验HGB-210中的2名患者,每名患者的随访时间为18个月。BLA递交还包括整个lovo-cel项目中50名接受治疗患者的安全性数据,其中6名患者的随访时间达到或超过6年。
活性成分:eplontersen
适应症:转甲状腺素蛋白介导的淀粉样变性多发性神经病
公司名称:Ionis Pharmaceuticals,阿斯利康
Eplontersen为一款一月一次,可由患者自己皮下注射的在研反义寡核苷酸(ASO)药物,其采用的反义寡核苷酸配体偶联(LICA)技术,可以将ASO药物与能和细胞表面特定受体结合的配体分子偶联在一起。LICA技术能有效地将ASO选择性递送到表达这些受体的细胞中。Eplontersen可用以抑制转甲状腺素蛋白(TTR)的生产,从而治疗遗传性与非遗传性的淀粉样变性多发性神经病。此药已获得美国FDA授予孤儿药资格。
今年4月发布的3期临床试验结果显示,在接受治疗66周时,患者在血清TTR浓度、神经病损伤和生活质量这三个共同主要终点上表现出持续且稳定的效益:
Eplontersen使血清TTR浓度从基线降低平均82%,而外部安慰剂组从基线降低了11%(p<0.0001)。
Eplontersen使通过改良神经病损伤评分+7(mNIS+7)测量的疾病进展停滞,与基线相比只增加了0.28分,而外部安慰剂组增加了25.06分(p<0.0001)。与基线相比,66周时eplontersen组患者中有47%的神经病损伤获得改善,而外部安慰剂组为17%。
Eplontersen组的生活质量指标(Norfolk QoL-DN)显示出降低5.5分,意味着症状改善,而外部安慰剂组增加了14.2分,表示疾病恶化(p<0.0001)。与基线相比,66周时eplontersen组患者中有58%的生活质量改善,而外部安慰剂组为20%。
活性成分:gefapixant
适应症:慢性咳嗽
公司名称:默沙东(MSD)
Gefapixant是一种口服选择性P2X3受体拮抗剂。P2X3受体的过度激活与感觉神经元的超敏化(hyper-sensitization)有关。损伤或感染引发的气道和肺部神经元超敏反应可引起过度,持续和频繁的咳嗽。日本厚生劳动省于2022年批准了gefapixant(商品名:Lyfnua)45 mg片剂的上市申请,用于治疗患有难治性或不明原因的慢性咳嗽的成年患者。欧盟委员会在今年9月批准gefapixant上市。
此前,默沙东宣布gefapixant在治疗顽固性或无法解释的慢性咳嗽成人患者的两项关键性3期临床试验COUGH-1和COUGH-2中达到主要疗效终点。与安慰剂相比,gefapixant能显著减少患者的咳嗽频率。不过在近日结束的美国FDA肺部和过敏药物咨询委员会上,与会专家以12:1的投票结果,认为目前的证据不足以证明gefapixant能够为难治性或不明原因的慢性咳嗽成人患者提供具有临床意义的获益。
活性成分:donanemab
适应症:阿尔茨海默病
公司名称:礼来
Donanemab是一款靶向β淀粉样蛋白的单克隆抗体,它在2期临床试验中达到主要终点,将早期阿尔茨海默病患者的临床进展速度延缓32%。在生物标志物研究中,donanemab不但导致淀粉样蛋白沉积的快速清除,而且显著降低患者血浆中P-tau217的水平。这是礼来开发的一个在研血液生物标志物,与淀粉样蛋白和tau蛋白病理,以及AD的诊断相关。即使在停止donanemab用药一年后,P-tau217水平仍然显著降低。FDA已经授予donanemab的BLA优先审评资格。
今年7月发布的3期临床试验TRAILBLAZER-ALZ 2的完整结果显示,donanemab可显著减缓具有阿尔茨海默病早期症状患者的认知与功能下降、延缓疾病进展。在所有淀粉样蛋白阳性的早期症状性AD患者中(n=1736),使用donanemab分别显著减缓iADRS与CDR-SB评分下降达22%与29%。亚群分析显示,在轻度认知障碍患者(n=214)中,donanemab治疗导致患者iADRS评分衰退速度减缓达60%,在CDR-SB评分衰退速度减缓达46%。

 产业资讯
产业资讯
 新湾novaBAY
新湾novaBAY  2025-06-30
2025-06-30
 50
50

 产业资讯
产业资讯
 MedTrend医趋势
MedTrend医趋势  2025-06-30
2025-06-30
 51
51
 产业资讯
产业资讯
 Medaverse
Medaverse  2025-06-30
2025-06-30
 47
47