 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2023-12-21
2023-12-21
 3548
3548
经过三年多的试点,随着2019年新修订《药品管理法》的发布实施,药品上市许可持有人制度(MAH制度)在我国全面铺开。MAH制度是将上市许可和生产许可相分离的药品管理制度,这一制度的落实对优化资源配置、促进医药创新起到了极为重要的作用。
但随着产业和MAH制度深入发展,一些问题逐步暴露出来,主要表现在:①B类许可证(委托生产的药品上市许可持有人)数量激增,部分企业资质有待审核;②委托生产关系复杂,委托方和受托方的契约履职不到位;③部分MAH企业在全生命周期的管理上存在不敢、不会、不愿等问题;④面对新制度,部分省局监管能力尚待进一步提升等。
为了更好地落实和细化MAH制度落实过程中的问题,明确监管方、委托方、受托方的职责,2023年10月,国家药监局发布了《关于加强药品上市许可持有人委托生产监督管理工作的公告》(2023年第132号,以下简称“132号文”),随后国家药监局综合司印发落实文件《关于印发药品上市许可持有人委托生产现场检查指南的通知(药监综药管[2023]81号)》。132号文是MAH制度在我国执行以来,对委托生产发布的最为细致、最为严格的文件。鉴于本文件的重要意义,其起草、意见征集和发布的整个过程,都引起了学界、产业界的热烈讨论。目前,该文件已发布两个月,由此引发的产业变化初见成效。2023年度,中国药促会政策研究中心完成了关于MAH制度的课题研究,特此根据产业形势的最新变化,分享相关课题成果,与读者共同探讨。
一 “最细最严”委托生产文件,明确了哪些规定?
严格生产许可证管理
针对MAH制度执行以来,B类许可证数量爆发式上升,但部分管理能力不足、小而散乱的企业也掺杂其中的问题。新规中进一步明确:一是严格核发,尤其强调受托生产企业所在地省药监局出具的GMP符合性告知书、同意受托生产的意见,同时明确药监部门通过事前沟通指导申请人完成临床试验、工艺验证后方能核发许可证;二是细化检查,对于关键岗位人员、质量管理体系、委托生产的管理情况等进行重点检查,强调现场检查的重要性;对于有过不良记录的企业加强现场审核和延伸检查;三是严控风险,对于风险较高的生物制品、中药注射剂、多组分生化药另外提出更为严格的要求,如近5年的生产销售记录、受托生产企业同类型产品3年连续生产的记录等。
强化委托生产质量和监督管理制度建设
重点对受托企业本身的资质和生产过程进行管理,主要包括:一是对于MAH质量管理的体系、人员和规范进行硬性的要求,对受托企业进一步加强定期评估和审核,保证双方质量管理体系的一致和互通;二是继续推进属地监管加强协同,属地部门对委托生产进行监督管理,MAH所在地监管部门承担品种的监管和持有人的监管,双方监管部门强化监管信息共享合作;三是强化对从物料、变更、放行、检验全流程管理,特别提出对于多品种的共线生产要格外重视。
强调“人”的作用,对关键岗位人员资质提出细化要求
132号文进一步强调关键人物的资质要求,包括不限于:部门设置,要求管理部门必须配备与药品生产经营规模相适应的管理人员;资质要求,无菌药品关键人员需5年以上生产和质量管理经验,其中3年以上为无菌产品工作;生物制品、中药注射剂和多组分生化药需3年以上生产管理经验同时需要委托方另外派驻相关经验人员进行指导监督;定期考核,文件要求各省局加强关键岗位人员培训考核,提升合规水平。
二 新规出台后产业的最新变化
B证发放数量放缓,区域结构开始发生变化
自2019年12月我国全面实施MAH制度以来,基于药品上市许可与生产许可的分离,我国大批研发机构和企业注册成为MAH。2021年1月至2022年底,我国B证企业从140家增至791家,增长率高达465%,截至2023年11月30日,全国B证企业数量达到1172家,与去年同期相较,增长率为48%,B证数量增长速度在放缓,特别是132号文出台后之后,B证企业集中于试点十省市的状况开始发生变化,越来越多的企业选择落户于中、西部地区,海南、湖北、黑龙江等省份B证数量提升较为显著。
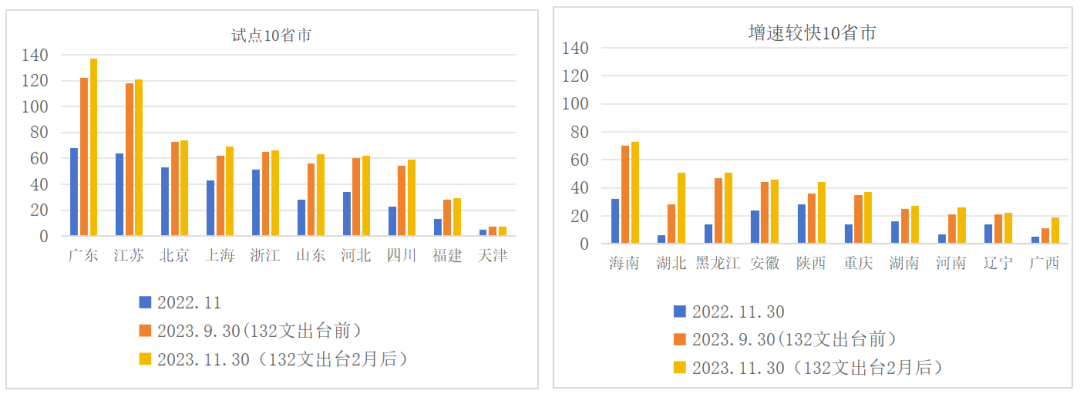
图 2022.11-2023.11全国部分省市B证企业数量 数据来源:钱塘研究院、中国药促会整理
MAH委托关系愈发复杂,多省多地委托情况愈发普遍
在实践过程中,国家通过集中带量采购提升群众用药可负担性,通过鼓励创新药的发展提升用药可及性。委托生产通过集中生产资源,一方面降低了生产成本,提高了监管效率,另一方面减轻了研发企业的负担,因此,随着产业深入发展,委托生产规模逐步扩大,MAH委托关系也越来越复杂。
从国家集采药品看,2023年11月6日,第九批国家集采目录公布,205家企业的266个产品中选,在目录产品中,共有74项产品为委托生产,占比为27.8%。与前八次集采目录产品相较,委托情形更为复杂,主要表现在,其中六成以上为跨省委托,5项产品委托2家以上受托方负责生产,有多家受托企业承担2项以上品种的生产,由此可能引发更为复杂的区域监管协同、共线生产等问题。
从国产创新药看,截至2023年11月30日,2019-2023年NMPA共批准89个国产创新药,其中27个药品采取委托生产模式,占比为30%,跨省委托生产达20个。
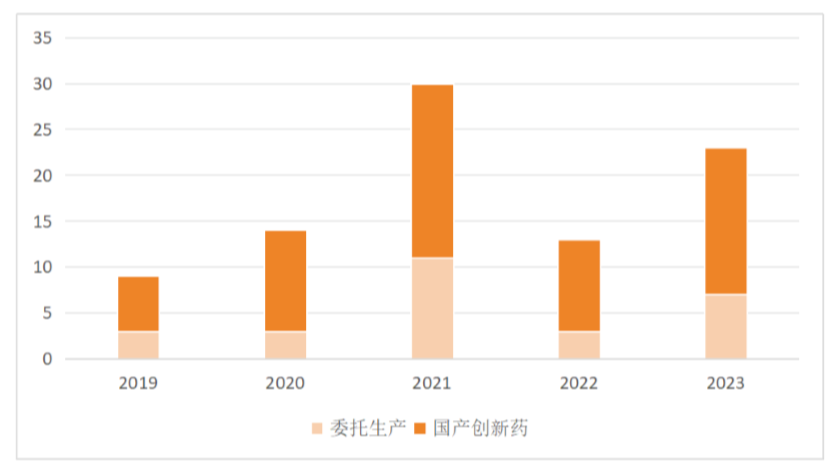
图1:2019-2023年国产创新药以及其中委托生产占比 数据来源:药渡数据、中国药促会整理
国际化趋势加快,GMP水平亟待统一和提升
2023年11月8日,国际药品认证合作组织(Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme,PIC/S)致函国家药监局,正式确认国家药监局申请人身份。值得注意的是,根据PIC/S的相关规定,在正式申请后6年之内,需根据检查清单完成证明性材料文件,证明本国的GMP水平已达到成员国的要求标准,也就是说我国各省GMP的水平必须在几年内实现加速提升和统一。
表 PIC/S审计清单概要
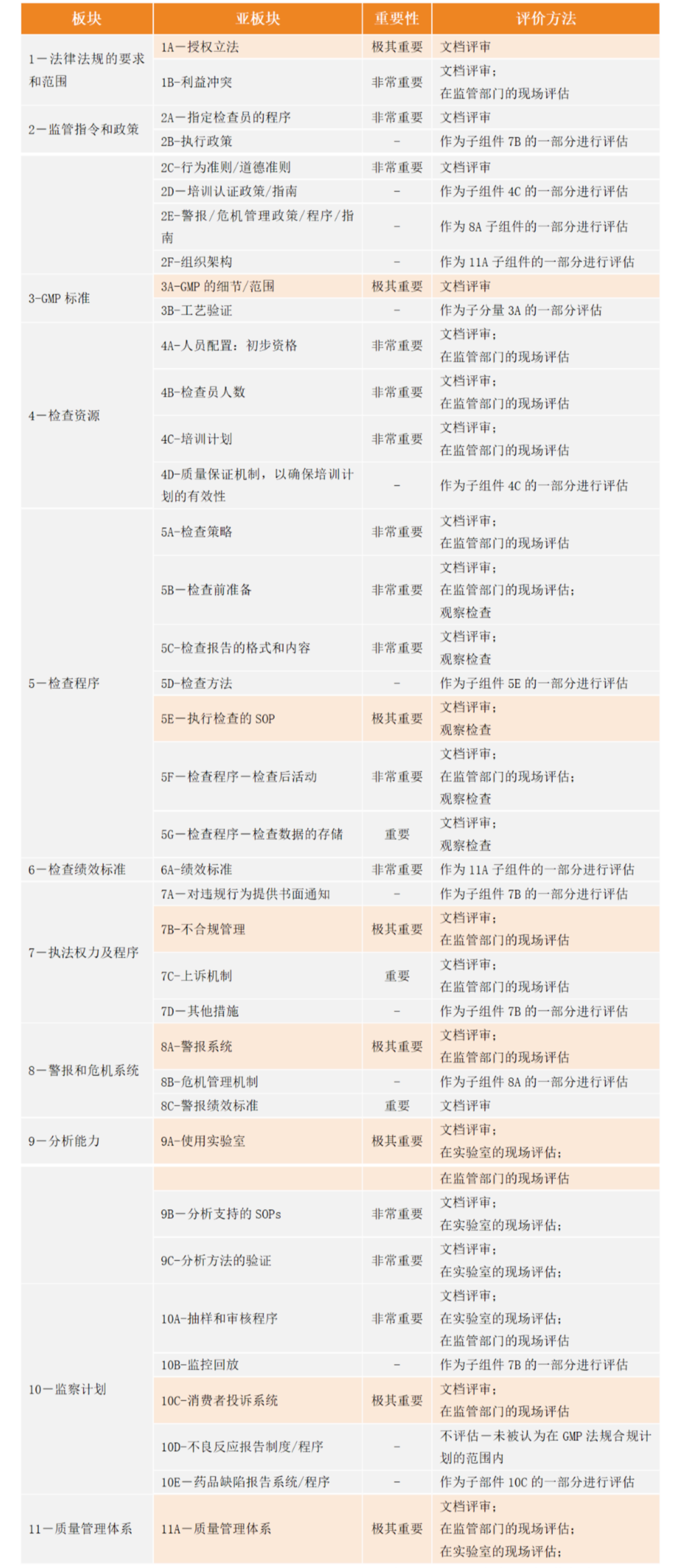
来源:PIC/S官方网站 中国药促会翻译
三 面对新变化:各省的统一协作成为紧迫要求
MAH制度在我国经历了从试点到全面铺开的历程,因此区域之间的配套制度建设存在差异。132号文发布前后,江苏、浙江、山东等地也纷纷出台了关于委托生产、注册变更等相关细则,同时内蒙古、广西等部分地区尚处在MAH制度建设的探索阶段,为加快创新产业发展,出台了相关政策吸引B证企业入驻,各省MAH制度成熟度差异较大、跨省委托形势复杂,加之成为PIC/S正式申请者带来的时间限制,对我国MAH制度建设标准一致性和高效协同提出了紧迫的要求。根据我会研究成果,分享以下建议:
对省局监管能力统一硬性要求
对标国际标准,建立省局监管和GMP检查能力提升时间表,开展统一的监管能力培训,由国家药监局牵头,各省局相关负责人、检查员参与,邀请国际标准机构专家、国家局以及部分先行省局专家进行指导、交流,通过共享培训资源、互派检查人员、合作课题研究等方式,达到统一监管理念、实现资源共享、优势互补,在我国正式加入PIC/S之前,保证各省局的监管能力达到国际标准要求。
创新监管机制,探索建立以产品为主线的监管体系
对各省的监管能力开展评级,给予部分监管水平较高的省局跨区域监管资质,对高风险产品,以产品而非属地为主线,由具备资质的省局进行跨省监管,一方面激励各省局提高监管能力水平,实现相互促进,另一方面保证相应产品得到有效监管,严控风险。
加强区域信息化协同
目前药品监管信息化建设存在系统建设分散、数据支撑不够等问题,建议在企业方要求MAH和受托企业必须建立药品全生命周期的数字平台,检查数据、GMP等合规数据公开透明,保证原始数据可跨省、可追溯、重要信息可共享,保证药品质量,保障公众用药安全;在监管方建立全国统一的数字化监管互通平台,对于关键检查结果、合规信息公开透明,各省监管方与MAH、受托方间信息畅通,可尽早发现潜在风险,及时降低相关风险。
中国医药创新促进会 政策研究中心
作者:吴琼文倩 助理研究员 wuqwq@phirda.com
审核校对:张志娟
参考文献:
国家药监局药品监管司《关于加强药品上市许可持有人委托生产监督管理工作的公告》线上宣贯会
钱塘MAH研究院.中国MAH产业发展报告蓝皮书[EB/OL].(2023-07-20).
广西和山东的B证更好批?11月全国B证数据公布! 药闻天下 2023-12-5

 产业资讯
产业资讯
 新药说
新药说  2025-06-16
2025-06-16
 63
63

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-06-16
2025-06-16
 63
63

 产业资讯
产业资讯
 猎药人俱乐部
猎药人俱乐部  2025-06-16
2025-06-16
 67
67