 产业资讯
产业资讯
 医麦客
医麦客  2024-04-08
2024-04-08
 2185
2185
据统计,2024年国内细胞治疗领域在第一季度共有44款细胞疗法取得临床申报进展,包括28款免疫细胞疗法和16款干细胞疗法,其中科济药业的泽沃基奥仑赛注射液获批上市,是第一季度唯一一款获批上市的细胞疗法,给细胞疗法市场注入了新活力。三个月间,CDE共有28项IND获得受理,16项获批IND即将进入临床,整体申报/获批数量相较于去年第一季度增加近20%。
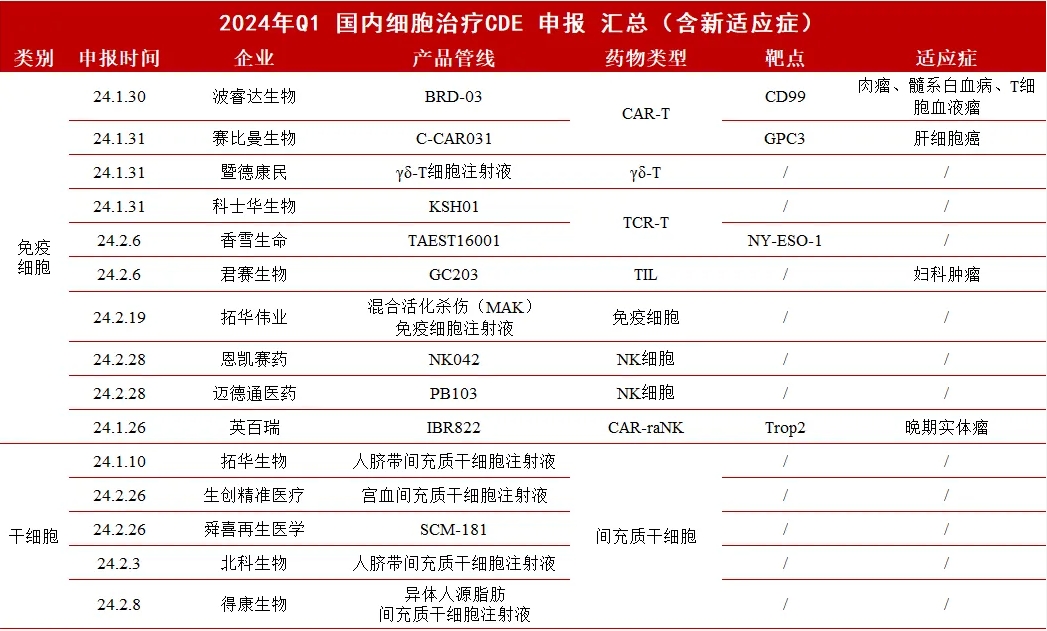
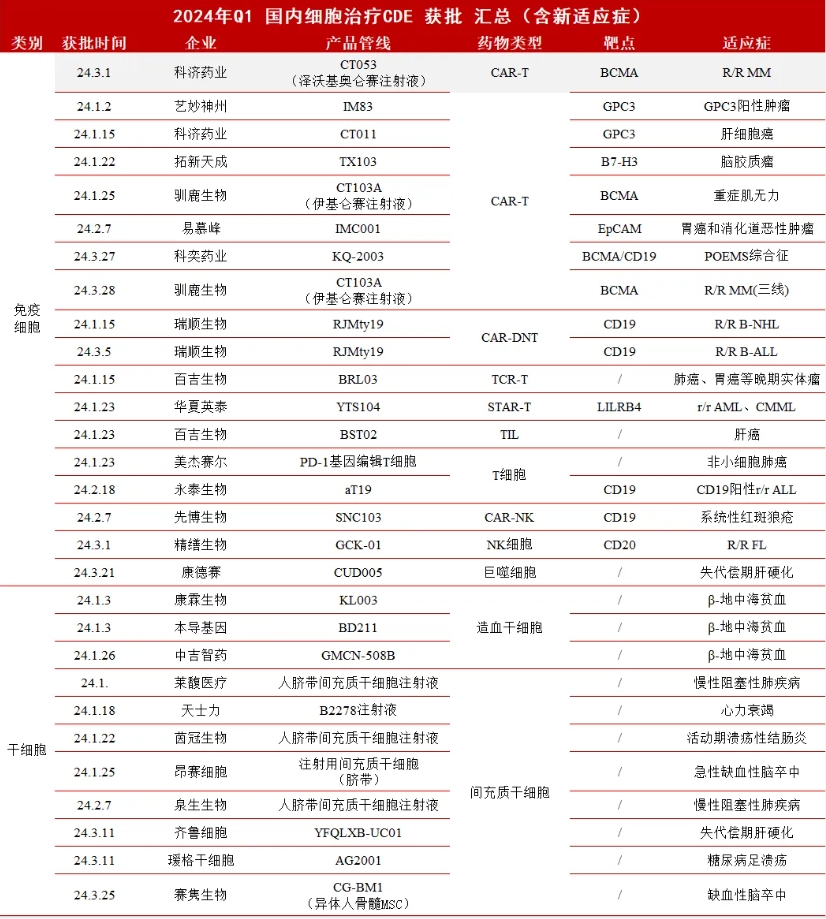
▲ 2024年第一季度国内细胞治疗领域临床申报进展 (医麦客整理,如有遗漏欢迎指正)
医麦客过往数据显示,2023年Q1申报临床的细胞疗法从2022年不足10款激增至36款,今年更是在此基础上再次实现跨越式增长近20%,足可见细胞治疗药物的开发势头依然强劲。即使是把干细胞和免疫细胞分开来看,各自领域内都是一片欣欣向荣,为整个赛道的蓬勃发展不断注入新动力。(篇幅考虑,本文仅就临床获批的管线进行简介扩展)
免疫细胞疗法上演百家争鸣
过去的一年里,最为瞩目的CAR-T领域获批上市的产品突破10款,国内也迎来了第五款上市CAR-T产品,实现了跨越性进展;首款TIL疗法Amtagvi(lifileucel)获批上市,标志着细胞治疗进入治疗实体瘤新时代;Afami-cel的上市也蓄势待发,有望成为全球首款TCR-T疗法。除了成绩斐然,整个免疫细胞疗法行业都处于迭代升级的潮头之上。
从表可知,第一季度的免疫细胞疗法中的IND临床申报受理的共计10款,17款获批临床,1款获批上市。一个比较有趣的现象是,在有临床进展的28条管线中,CAR-T仅占9款,占比较去年有进一步降低的趋势,也侧面证明了免疫细胞疗法不断向细分领域多样化、差异化发展。
得益于前沿科技的进步与产品设计与生产技术的不断突破,以及TIL、TCR-T等多种疗法成药路径的走通,免疫细胞药物赛道从CAR-T单一竞品已经转变成CAR-T、TCR-T、TIL、NK、CTL等多种差异化的新型免疫细胞疗法并驾齐驱的发展趋势,今年还涌现了诸如混合活化杀伤(MAK)细胞、PD-1基因编辑T细胞等新型细胞治疗分类,呈现出百家争鸣的免疫治疗盛世景象。
科济药业
2024年3月1日,科济药业自主研发的针对BCMA靶点的CAR-T细胞治疗药品泽沃基奥仑赛注射液(CT053,商品名:赛恺泽)的新药上市申请(NDA)获得国家药品监督管理局(NMPA)正式批准,用于既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)等治疗复发或难治性多发性骨髓瘤成人患者,是国内上市的第5款CAR-T细胞治疗药品。
泽沃基奥仑赛注射液是一种通过慢病毒转导T细胞产生的自体CAR-T细胞产品。慢病毒编码的CAR包括全人源BCMA特异性单链可变片段(“scFv”),人CD8α铰链结构域、CD8α跨膜结构域、4-1 BB协同刺激结构域以及CD3ζ激活结构域。自研的新全人源scFv具有较高的结合亲和力和稳定性。
此外,1月15日,科济药业(CARsgen)研发的靶向GPC3的自体CAR-T细胞候选产品CT011已在中国获批临床,拟开发用于治疗手术切除后出现复发风险的GPC3阳性的IIIa期肝细胞癌患者。
CT011可表达整合了人源化GPC3特异性单链片段变体的CAR,旨在有效靶向和消除细胞表面上携带GPC3蛋白的肝细胞癌。CT011曾于2019年获得中国国家药监局(NMPA)的IND批准,用于治疗GPC3阳性实体瘤患者,这是中国首个针对实体瘤的CAR-T细胞疗法的IND,科济药业已在中国完成了这项的I期临床试验的患者入组。
艺妙神州
1月2日,据CDE官网显示,北京艺妙医疗科技有限公司自主研发的“IM83嵌合抗原受体T细胞注射液(IM83 CAR-T细胞注射液)”获得CDE临床试验默示许可,受理号为CXSL2300680,拟用于治疗GPC3阳性肿瘤患者。
靶向GPC3的IM83 CAR-T采用了新一代CAR分子设计,显著提高了CAR-T细胞在体内抑瘤的持续性,使其能更有效和持久地与肿瘤细胞战斗。2023年6月,这款候选产品已经获批临床,用于治疗晚期肝癌,这个批件是艺妙神州获批的第4个CAR-T细胞药物临床批件,也是首个用于治疗实体肿瘤的CAR-T细胞药物临床批件。
拓新天成
2024年1月22日,据CDE官网显示,拓新天成的TX103嵌合抗原受体T细胞注射液获批临床,拟用于治疗复发或进展的4级脑胶质瘤。该疗法已经在中美两国获批开展临床,此次为新适应症获批。在2022年8月,TX103获批临床,拟用于TX103阳性、既往经标准治疗失败或发生不可耐受毒性、经病理确诊的晚期实体瘤患者。
TX103 CAR-T是一款靶向B7-H3的CAR-T疗法。B7-H3靶点属于B7配体家族成员,在多种癌症中过度表达而在正常组织中低水平表达或不表达。B7-H3具有非免疫原性功能,如促进迁移和侵袭、血管生成、化疗耐药、内皮细胞向间充质细胞转化以及影响肿瘤细胞代谢,其在肿瘤中的表达与预后不良有关,在肿瘤免疫治疗中颇具应用价值。
驯鹿生物
2024年1月25日,驯鹿生物驯鹿生物已上市产品伊基奥仑赛注射液(CT103A)的新药临床试验申请(IND)获中国食品药品监督管理局(NMPA)批准,受理号为CXSL2300759,新增扩展适应症难治性全身型重症肌无力(MG)。
本次重症肌无力IND的获批进一步拓展了伊基奥仑赛注射液的适应症范围,这也是其继视神经脊髓炎谱系疾病(NMOSD)后获批IND的第二个自免领域适应症。驯鹿生物是国内率先将CAR-T产品用于自免适应症的公司,有望改变自免疾病的治疗格局。
3月28日,伊基奥仑赛注射液再次获NMPA批准,拟扩大适应症用于治疗既往经过1-2线治疗且来那度胺耐药的复发/难治性多发性骨髓瘤患者。此前,2023年6月30日在中国上市时,获批适应症为既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)的复发或难治性多发性骨髓瘤成人患者。本次获批BCMA CAR-T的提线治疗申请,是伊基奥仑赛注射液在临床开发进程中又一重大里程碑。
易慕峰
2月7日,易慕峰宣布其自主研发的靶向EpCAM的自体CAR-T细胞注射液产品(IMC001)的临床试验申请获得中国国家药品监督管理局药品审评中心(CDE)的默示许可(受理号:CXSL2300792),拟用于治疗EpCAM表达阳性的晚期消化系统肿瘤,包括但不限于晚期胃癌(GC)/食管胃结合部腺癌(GEJ)。
IMC001成为全球首个获批IND的靶向EpCAM的CAR-T产品,也是全球首个中美双报获批IND的靶向EpCAM的 CAR-T产品,于2023年8月获得了两项美国FDA孤儿药资格(ODD)认定,分别用于治疗胃癌和胰腺癌。易慕峰从实体瘤治疗痛点和临床获益出发,首倡“化实体瘤为血液瘤”的临床策略,并在此基础上开发了Peri Cruiser®技术平台,同时还开发了SNR、T-Booster等技术平台,旨在提高CAR-T产品的安全性、对抗肿瘤异质性以及提高其扩增和浸润肿瘤的能力。
科奕药业
2024年3月27日消息,科弈药业宣布其自主研发的新一代增强型双靶CAR-T产品——KQ-2003自体CAR-T细胞注射液,已获得国家药品监督管理局药品审评中心(CDE)的临床试验默示许可。这一创新疗法将针对复发/难治性POEMS综合征展开临床试验,标志着全球首款针对该罕见病的CAR-T细胞治疗进入临床阶段。
KQ-2003是科弈药业第三个进入临床的创新药项目,其独特之处在于能同时靶向BCMA和CD19两个治疗靶点,有望为更多复发/难治性多发性骨髓瘤及POEMS综合征患者带来新希望。
瑞顺生物
广东瑞顺生物的CD19-CAR-DNT细胞药“RJMty19注射液”,在短短一个季度之内获得了两个IND批件,分别是2024年1月15日的复发/难治性 B细胞非霍奇金巴瘤(CXSL2300725),和3月5日的CD19阳性的成人复发/难治性B细胞急性淋巴细胞白血病。该产品获批的首个IND申请为2023年12月20日获批拟用于难治性系统性红斑狼疮(CXSL2300661)适应症,是全球首个治疗难治性系统性红斑狼疮的现货通用型细胞药,再次提高了细胞疗法在自免适应症方面的可及性,将细胞治疗应用转化推上新台阶。
三个月内完成了三个适应症相继获批注册临床试验的大满贯,表明RJMty19注射液作为全球首款未经基因编辑的“现货通用型”CAR-DNT免疫细胞治疗产品,DNT细胞的天然优势以及瑞顺生物在制备现货通用型DNT细胞上的领先优势不但能让中国在细胞治疗领域有可能站在前列,引领世界。
百吉生物
TCR-T方面,2024年1月15日,据CDE官网公布,百吉生物第三条全球独家首创产品管线BRL03注射液新药临床试验获批,拟用于治疗多种晚期实体瘤,包括肺癌和胃癌等,并完成了中美双批。
BRL03注射液的NMPA IND申请获得批准,标志着百吉生物已正式获得第7个全球首创产品的IND临床批件。作为百吉生物自主研发的首款进入临床的TCR-T产品,IIT研究显示BRL03注射液在实体瘤治疗中具有良好的安全性和初步疗效。百吉生物的自主创新技术平台IDENTIFIER®为抗原、抗体和TCR的发现和鉴定提供了强大的支持。利用来自上千个体的TCR和肿瘤蛋白组数据库,百吉生物可以在两周内筛选和优化针对不同治疗需求的合适开发资产。通过该平台,百吉生物筛选出具有广泛受众群体,兼具高特异性和亲和力的、针对多种实体肿瘤的TCR。
TIL方面,百吉生物第四条全球独家首创产品管线BST02注射液IND申请于2024年1月23日在华获批,拟用于治疗所有类型的肝癌(包括肝细胞癌和胆管癌),属于过继性免疫细胞治疗技术。此前,2023年10月26日获得FDA批准临床,成为全球首款进入临床开发阶段的肝癌TIL疗法。并已获得FDA快速通道资格认定。
BST02注射液作为一种基于患者自身肿瘤浸润淋巴细胞扩增的T细胞治疗产品,属于过继性免疫细胞治疗技术,具有治疗所有类型肝癌的潜力,为肝癌患者提供了新的希望。与传统的TIL药物相比,BST02具有更多的优势,如是冻存产品,突破了距离的限制、无需高剂量白介素-2辅助用药等。
华夏英泰
2024年1月23日,华夏英泰的合成性T细胞受体抗原受体(STAR-T)注射液(研发代号:YTS104)临床试验申请已获得默示许可,受理号CXSL2300757,拟用于治疗复发/难治急性髓系白血病(R/R AML)。该产品曾于2022年12月26日获美国FDA孤儿药资格认定。
YTS104针对的靶点LILRB4(又称ILT3,CD85k)的自体细胞治疗产品,是基于华夏英泰开发的创新STAR-T平台的自体型细胞治疗药物。该产品采用慢病毒基因转导方式,将特定STAR基因导入自体T细胞内,经体外细胞扩增制备、功能和质量控制检测而获得的细胞治疗药物。产品优势为采用两个自主筛选的不同表位的纳米抗体,分别连接在STAR结构的α链及β链上,预期具有更好的抗原识别和杀伤作用。YTS104是不同于目前CAR-T细胞疗法在血液瘤研究较为集中的CD19、BCMA等靶点的差异化探索。
美杰赛尔
2024年1月23日,美杰赛尔所提交的PD-1基因编辑T细胞注射液新药临床试验申请(IND)获国家药品监督管理局默示许可,受理号为CXSL2300758,拟适应症为晚期非小细胞肺癌。
此前,成都美杰赛尔生物科技有限公司与四川大学华西医院联合完成世界首例基因编辑细胞人体临床试验,曾被Nature头版头条新闻评述认为“触发了中美生物技术竞备赛”。2020年4月以一个完整的I期临床试验结果展示在《Nature Medicine》重磅刊登。这也是目前为止全球完成例数最多的基因编辑细胞治疗肿瘤I期临床试验报告。
尽管在IIT一期临床试验中已证明基因编辑细胞产品的科学性和安全性,但美杰赛尔并未急功近利马上启动IND申报,而是潜心工艺迭代优化、精耕细作,形成了更高效、低毒、稳定的编辑和细胞工程化扩增体系。编辑效率由当初一代工艺的20-30%提升到目前的90%以上,而且细胞编辑后的扩增倍数也大幅提高,药学工艺更加稳定可控。
永泰生物
2月20日,永泰生物宣布aT19注射液成功获得中国国家药监局药品审评中心(CDE)临床试验批准,受理号为CXSL2300808,拟用于25岁(含)以下复发/难治B细胞急性淋巴细胞白血病(B-ALL),在靶向CD19 CAR-T细胞治疗后临床获益的患者,以增强治疗效应、减少复发。据永泰生物新闻稿介绍,本次获批1期临床研究将于2024年内开展。
公开资料显示,aT19注射液主要功能成分为经过基因改造而强制表达CD19的自体T细胞。aT19注射液在CAR-T-19注射液给药后回输,具有再度激活CAR-T细胞,再次启动CAR-T细胞的增殖,增加免疫记忆细胞的潜力。根据前期研究者发起的临床研究(IIT)结果,受试者在接受aT19序贯CAR-T细胞治疗后,微小残留病灶(MRD)阴性持续缓解均已达3年以上,研究过程中未报告不良反应。初步验证了aT19注射液序贯CAR-T细胞治疗的可行性与有效性。
先博生物
2024年2月7日,先博生物自主研发的靶向CD19的嵌合抗原受体基因修饰的NK细胞注射液正式获得国家药品监督管理局药品审评中心(CDE)的临床默示许可,拟适应症为中重度难治性系统性红斑狼疮(SLE)。这是SLE适应症在国内首个通用型NK产品获批IND,临床进度甚至有望成为全球领先。
先博生物的首个CAR-NK产品管线SNC103已经在研究者发起的临床研究(IIT)阶段取得了积极结果。在产品开发过程中,先博采用了创新设计的拥有自主知识产权的CAR结构,临床前研究中展示出了比同类CAR设计更优效的活性。同时,先博生物拥有成熟稳定的大规模通用型NK细胞制备的CMC能力。NK的CAR转导效率,扩增水平,以及冻存复苏后的细胞活性都达到了行业领先水平。该公司研发的另一款携带两个CAR分子的双CAR-T细胞疗法SNC109也已经在中国获批临床,并被美国FDA授予孤儿药资格,用于治疗恶性胶质瘤。
精缮生物
3月1日,据CDE官网公示,复星医药控股子公司精缮生物自主研发的“GCK-01细胞注射液”获得临床试验默示许可,受理号为CXSL2300843,拟开展用于治疗复发或难治性滤泡性淋巴瘤的临床试验。
精缮生物自主研发的GCK-01是一款靶向CD20的NK细胞疗法,为同源异体外周血来源的现货型NK细胞治疗产品。根据精缮生物官网信息,此前由研究者发起的一项临床试验已正式启动,该研究将主要评估GCK-01 NK细胞注射液联合利妥昔单抗治疗复发或难治性B细胞非霍奇金淋巴瘤患者的安全性和耐受性。
康德赛
3月21日,康德赛医疗宣布公司研发的“CUD005注射液”获批临床试验默示许可,受理号为CXSL2300903,拟适应症为中晚期肝硬化,象征着国内首个个体化抗纤维化巨噬细胞治疗药物成功迈入注册临床试验阶段,这一成就为肝硬化治疗领域开辟了全新的前景。
巨噬细胞注射液CUD005是基于患者自身免疫细胞,使其分化为成熟、稳定的个体化抗纤维化巨噬细胞。相较于功能单一的传统小分子药物,CUD005具有多项优势,其通过分泌多种基质金属蛋白酶(MMPs)来有效降解胞外基质,减少肝脏瘢痕淤积;此外,它可以释放抗炎因子(IL-1RN等),进而抑制炎症反应的发生,改善肝脏炎症微环境,减缓病情发展。CUD005也展现出强劲的凋亡细胞吞噬能力,对肝脏正常结构的恢复起到推进作用。CUD005注射液已在治疗肝纤维化方面展现出独特优势,可有效去除过度激活的肝星状纤维细胞和过度分泌的胞外基质,延缓肝硬化及其失代偿期的发生,改善患者生活质量并延长其生存期,为中晚期肝硬化患者带来了全新的治疗选择。
干细胞拓展新的可能性
2023年干细胞治疗领域最重磅的消息莫过于,美国FDA终于批准了第一款同种异体干细胞治疗药物Omisirge,用于血液系统恶性肿瘤的治疗,实现了0的突破,给全球干细胞药物研发领域释放了积极信号。从覆盖的适应症方面,干细胞治疗涉及适应症包括自身免疫性疾病(类风湿关节炎、强直性脊柱炎、银屑病、移植物抗宿主病)、代谢性疾病(糖尿病足溃疡)、骨关节病(骨关节炎)、呼吸系统疾病(肺纤维化、肺损伤)、消化系统疾病(肝衰竭、克罗恩病)、心脑血管疾病(脑卒中)等病种,不断扩展边界,给患者治愈疾病带来新希望。
从表可知,第一季度的免疫细胞疗法中的IND临床申报受理的共计5款,11款获批临床。比较特别的是,在有临床进展的17条管线中,有3款为基于造血干细胞的疗法值得注意,在干细胞领域开拓了基因补偿治疗的应用方式,代表着前沿基因编辑技术与干细胞特性融合创新应用的重要拓展。
康霖生物
2024年1月3日,康霖生物自主研发的KL003细胞注射液成功获得中国国家药品监督管理局(NMPA)的临床试验默示许可,受理号:CXSL2300699,拟适应症为输血依赖型β-地中海贫血症。此为康霖生物首款默示许可的干细胞药物。
KL003细胞注射液通过慢病毒载体介导的β-globin基因转导自体造血干细胞并回输,达到一次性功能性治愈的效果。康霖生物与中国医学科学院血液病医院、广东医科大学附属医院,分别合作开展的IIT试验中,KL003临床试验结果远远优于目前国际上最领先的美国蓝鸟和福泰制药同类产品。
本导基因
1月3日,本导基因宣布BD211自体CD34+造血干细胞注射液的临床试验申请已获得中国国家药监局药品审评中心(CDE)默示许可,受理号:CXSL2300710,拟适应证为输血依赖型β-地中海贫血症。BD211是本导基因第二款获得IND批件的管线。
BD211是一款基于本导基因下一代慢病毒载体平台开发的基因修饰自体造血干细胞地中海贫血治疗药物,属于基因补偿治疗产品。通过引入专利性绝缘子设计,优化β珠蛋白基因表达序列,不仅降低慢病毒载体的整合突变风险,提升了产品安全性,而且通过基因补偿将患者的血红蛋白修复至健康人的生理状态,有望提高治疗效果。
中吉智药
2024年1月26日,中吉智药申报的基因治疗β-地中海贫血药物GMCN-508B的临床试验(IND)申请,获国家药品监督管理局药品审评中心(CDE)默示许可,标志公司正式进入注册临床试验阶段。
GMCN-508B的核心原理在于利用慢病毒载体这一递送工具,将功能性β珠蛋白基因导入到患者自身的造血干细胞中,从而纠正突变基因带来的缺陷,促使患者体内重新生成正常的血红蛋白,达到治疗目的。这一创新疗法有望改写β-地中海贫血患者的治疗历史,从反复输血转向一次性根治。
莱馥医疗
2024年1月,上海莱馥医疗科技有限公司按新药1类提交的“人脐带间充质干细胞注射液”获得新药临床试验默示许可,受理号:CXSL2300718,拟适应证为伴有肺间质异常的慢性阻塞性肺疾病。此外,莱馥医疗的“人脐带间充质干细胞注射液”也获批开展用于特发性肺纤维化(受理号:CXSL2101296)和间质性肺病(受理号:CXSL2300220)的临床试验。
据报道,“人脐带间充质干细胞注射液”从研发立项到产品开发完成,再到获得IND批件,总共耗时六年。近日,莱馥医疗研制的全球第一款拟用于特发性肺纤维化治疗的异体来源间充质干细胞制剂(人脐带来源的HuMSCs)的I期试验(CTR20221110)正在进行患者招募。
天士力
2024年1月18日,天士力医药集团股份有限公司提交的“人脐带间充质干细胞注射液(B2278注射液)”获得新药临床试验默示许可,受理号:CXSL2300728,拟用于伴冠状动脉旁路移植术指征的慢性缺血性心肌病导致的慢性心力衰竭。
此为天士力首款默示许可的干细胞药物。天士力在干细胞领域的布局是国内较早的一批。早在2018年,天士力认购了干细胞先锋企业Mesoblast约合1.34亿人民币的普通股,并引进其两款分别处于FDA临床III期及Ⅱ期试验的干细胞产品:MPC-150-IM用于治疗充血性心力衰竭,MPC-25-IC用于治疗急性心肌梗死,有偿获得在大中华区的独家开发、生产及商业化权益,代表天士力正式进军干细胞行业。天士力力争以“硬技术、金标准、新模式”构建领先的细胞治疗产业平台,目前正在推动创建首个干细胞质量评估数字化服务平台。
茵冠生物
2024年1月22日,茵冠生物提交的“人脐带间充质干细胞注射液”获得新药临床试验默示许可,受理号:CXSL2300747,拟适应症为中、重度活动期溃疡性结肠炎。此前,该款干细胞制剂已默示许可用于急性缺血性脑卒中,受理号:CXSL2200624。
茵冠生物已有4款干细胞新药IND申请获得受理,其中1款干细胞新药获得临床试验默示许可,该药物Ⅰ/Ⅱa期临床试验目前已在首都医科大学附属北京天坛医院、深圳市第二人民医院全面启动。茵冠生物建立了winSC™干细胞技术平台,形成了稳定可控的干细胞制剂生产工艺和完善的质量管理体系,开发了多项先进的干细胞制备技术,积极开发用于多种难治性疾病治疗的间充质干细胞和工程化干细胞产品,推进干细胞新药开发与再生医学转化。
昂赛细胞
1月25日,汉氏联合旗下天津昂赛细胞基因工程有限公司按新药1类提交的“注射用间充质干细胞(脐带)”获得新药临床试验默示许可,受理号:CXSL2300760,拟适应症为中、重度活动期溃疡性结肠炎。此前,该款干细胞制剂已默示许可用于移植物抗宿主病(受理号:CXSL1800101)、慢加急性(亚急性)肝衰竭(受理号:CXSL2000335)、急性呼吸窘迫综合征(受理号:CXSL2100056)、外伤性脊髓损伤(受理号:CXSL2200553)。
新闻稿指出,这是国际第一个获批治疗肝衰竭的干细胞药物临床试验。昂赛细胞于2006年申报了国内第一个异基因脐带间充质干细胞药物(受理号:CXSL0600068)。公司研发的注射用间充质干细胞(脐带)在2020年4月获国家药品监督管理局药品审评中心默示许可进入临床试验阶段,目前已有5个适应症的IND获批。
泉生生物
2024年2月7日,浙江泉生生物自主研发的生物1类新药“人脐带间充质干细胞注射液”(受理号:CXSL2300795),拟适应症为慢性阻塞性肺疾病,正式获得国家药监局药审中心(CDE)的药物临床试验默示许可,这也是泉生生物获得CDE批准的第5项干细胞临床试验项目。
早在2020年11月,亚洲干细胞集团旗下泉生生物联合四川省人民医院开展的干细胞临床研究项目“脐带间充质干细胞移植治疗乙肝后终末期肝硬化的单中心、前瞻性临床研究”成功获得项目与机构“双备案”。公司建立了“上海千人计划创业园区域细胞制备中心”,拥有符合国际cGMP标准的临床级细胞制剂制备车间1000㎡,是上海市细胞治疗产业重要基础平台,主要为医疗机构、科研机构等提供临床级、可回溯的细胞制品。
齐鲁细胞
3月11日,山东省齐鲁细胞公司首款干细胞药物IND获批,这也是山东省首款干细胞药物治疗肝硬化药物获批临床。
YFQLXB-UC01注射液是齐鲁细胞公司自主研发的冻存细胞制剂,间充质干细胞源自健康新生儿的脐带组织华通氏胶,在经过体外的分离扩增后与临床级冻存保护液混合制成了干细胞制剂。区别于传统的新鲜制剂,该剂型是一种“现货型”的产品,且复苏后无须洗涤即可用于静脉输注。公司以干细胞和免疫细胞技术为核心支撑,涉及产业上、中、下游的全链条产品研发,是细胞技术行业为数不多的涉及全产业链的高新技术企业。
瑷格干细胞
2024年3月11日,北京瑷格干细胞科技有限公司研发的“人脂肪间充质干细胞注射液”(代号:AG2001)获得国家药品监督管理局药品审评中心的临床试验默示许可,予以准许开展临床试验,拟适应症为糖尿病足溃疡,这是瑷格干细胞第三个产品获得临床试验默示许可。
截至目前,瑷格干细胞“人脂肪间充质干细胞注射液”AG1001、AG1002、AG2001管线产品适应症,均已获得国家药监局药品审评中心(CDE)临床试验默示许可,且AG1001管线成功完成三例受试者给药。
赛隽生物
3月25日,广州赛隽生物科技有限公司自主研发的CG-BM1异体人骨髓间充质干细胞注射液临床试验申请获得默示许可,受理号:CXSL2300909,新适应症为缺血性脑卒中。这是赛隽生物三年内第三个获批IND的自研产品,此前获批适应症为“感染引起的中重度成人急性呼吸窘迫综合征(ARDS)”和“慢加急性肝衰竭(ACLF)”。
CG-BM1是赛隽生物的第一代产品,本质上是成体来源、未经基因修饰的成体干细胞,赛隽生物最初对其定位是急危重症的抢救用药。因为间充质干细胞(MSC)的重要生物学特性是免疫调节功能,其免疫抑制能力远高于糖皮质激素,更关键的是在抑制免疫因子风暴的同时,不损伤免疫功能,从而降低继发的感染。因此,MSC在抗炎上有很好的应用场景。另外,MSC的免疫调节作用也与局部药物浓度密切相关。静脉输注MSC随血流在体内的自然分布主要集中在肺、肝两个器官,因此肺、肝这两个脏器因炎症引发的器官衰竭就成为赛隽生物的首选目标。
总结
从总体趋势而言,细胞疗法向实体瘤、自免领域以及血液肿瘤的前线治疗拓展,呈现多种创新型免疫细胞疗法并驾齐驱的发展趋势,既是乘着技术迭代、发展突破的风口,带来治愈疾病的更多打开方式;也是政府、患者、市场各方共同翘首以盼的发展方向与变革浪潮。仅从国内2024年第一季度的受理和获批数量来看,国内细胞治疗领域仍处于高速发展阶段,中国无疑在世界医疗技术迭代升级的浪潮中不断迈向世界中心,是在细胞治疗多样化与差异化的创新之路上不断探索的重要生力军。
一年之计在于春,第一季度的亮眼表现给2024年的细胞治疗领域再次注入了跨时代变革的动力。细胞治疗不仅是医疗变革浪潮的大势所趋,更是国家极为看重的发展布局。早在2022年5月,我国首部生物经济“五年规划”就明确,发展干细胞治疗、免疫细胞治疗等新技术,强化产学研用协同联动,加快相关技术产品转化和临床应用,推动形成再生医学和精准医学治疗新模式。在国家大力扶持的背景下,相信国内会有更多细胞领域的成果正在转化落地的路上。
参考资料:CDE及企业官网

 产业资讯
产业资讯
 清科研究
清科研究  2025-08-02
2025-08-02
 40
40

 产业资讯
产业资讯
 空之客
空之客  2025-08-02
2025-08-02
 42
42

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-08-02
2025-08-02
 42
42