 研发追踪
研发追踪
 药渡Daily
药渡Daily  2024-05-20
2024-05-20
 2305
2305
今日(2024年5月15日),从卫材官方公布信息可知,卫材已开始向FDA滚动提交用于每周维持剂量的Lecanemab-irmb(商品名:LEQEMBI®)皮下注射剂的生物制品许可申请(BLA)(FDA授予快速通道指定)。LEQEMBI适用于治疗轻度认知障碍(MCI)或轻度痴呆阶段(早期AD)的阿尔茨海默病(AD)患者。

本次BLA是基于Clarity AD(301研究)开放标签扩展研究(OLE)的数据和观察数据模型。Leqembi是一种皮下自动注射器,本次获批之后,可用于在家中或医疗机构注射,对于已完成两周静脉注射起始阶段的患者将接受每周360mg皮下注射剂量,以维持有效的药物浓度。
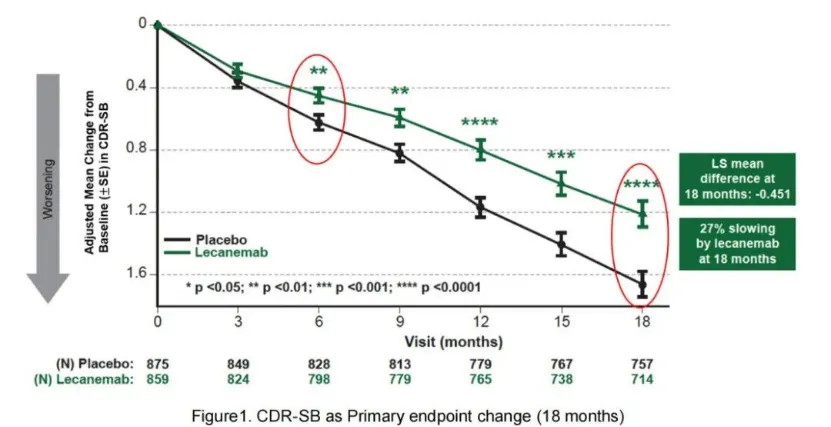
Lecanemab临床III期研究Clarity AD确认了临床获益:Clarity AD III期临床达到了降低CDR-SB评分主要临床终点和所有关键次要临床终点。在治疗18个月之后,在ITT人群中,Lecanemab相比安慰剂降低了27%的CDR-SB评分(降低了0.45分,p=0.00005)。
从药渡数据检索可知,Lecanemab注射剂于2022年1月6日获得FDA的加速批准,用于治疗轻度认知障碍或轻度痴呆阶段的AD患者;2023年6月10日,FDA外周和中枢神经系统药物咨询委员会专家以6:0的投票结果支持Lecanemab获得完全批准;2023年7月6日,Lecanemab成为首个获得FDA完全批准的抗Aβ单抗。
2024年Q1,Lecanemab销售收入为1900万美元,较2023年第四季度700万美元的收入增长了近三倍。自2023年底以来,目前使用Lecanemab的患者人数增加了近 2.5 倍。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 41
41

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 39
39

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 36
36