 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2024-06-04
2024-06-04
 775
775
医疗器械分类管理是各个监管程序的重要基础性制度,不仅关系监管工作的成效,也关乎着监管资源的合理配置。根据我国分类管理制度,一是根据医疗器械相关科技和产业高速发展,不断完善和更新分类规则与分类目录,二是确保面向新产品的分类界定结果的科学、一致,并且及时将有代表性产品增补至目录中,减少企业与监管机构分类界定负担。
本文回顾了医疗器械分类目录和分类界定工作程序的变化,浅析了当前医疗器械监管工作面临新形势新任务新要求,对未来改善的方向提出几点思考。
目录制与规则制相结合,支撑产品注册与监管
结合美国的“目录制”与欧盟的“规则制”,我国实行医疗器械分类规则指导下的分类目录制度,分类规则和分类目录并存,以分类目录优先,并根据监管需要对部分目录开展修订或发布分类界定文件作为补充。
2000年,国务院发布了首部医疗器械监管法规《医疗器械监督管理条例》(以下简称《条例》),重新定义医疗器械风险分类依据,第三类为最高风险等级,并提出评价医疗器械风险程度应当考虑医疗器械的预期目的、结构特征、使用方法等因素,分类规则逐步与国际接轨。同年,原国家药监局发布了《医疗器械分类规则》(以下简称《分类规则》),提出根据医疗器械的结构特性(有源/无源)、使用形式(按预期目的归类)、使用状况(接触/非接触)三方面进行综合判定,这一判断原则基本延续至今。随后在2002年发布《医疗器械分类目录》(以下简称《分类目录》),以便用于产品分类与注册。但由于医疗器械行业高速发展,《分类目录》层级结构不合理、内容单一、产品覆盖面小、更新维护不及时等问题逐渐显现,已不能完全满足监管和产业需求,由此,原国家食药监总局启动了修订工作,深入研究欧美日等发达国家的管理模式,全面分析我国医疗器械的监管和产业特点,新《分类目录》于2017年9月发布,2018年8月1日起正式实施。
新《分类目录》在产品管理类别调整方面,对上市时间长、产品成熟度高及风险可控的40种医疗器械产品降低管理类别,部分技术不够成熟、风险高的产品类别被升级,受到更加严格的审批和监管,同时将不具有医疗器械功能和目的的产品排除医疗器械管理范围。与2002版《分类目录》相比,新版目录的整体目录框架、层级框架和产品种类均有较大调整,具体见表1。
表1 《分类目录》主要变化

来源:NMPA,中国药促会整理
新增分类界定程序,衔接新型产品的研发
随着技术不断发展,对于不属于《分类目录》产品或者《分类目录》中产品的原材料、工艺等变化难以判断产品分类的情况,国家药监部门建立了分类界定服务,以确定产品管理类别。分类界定结果作为调整《分类目录》的重要来源之一,国家药监局基于实践基础逐渐明确界定流程以规范管理。
2013年,标管中心建立独立的门户网站,向社会提供分类进度查询及分类目录查询等服务的同时,建成并启用了“医疗器械分类管理系统”,基本形成了分类界定的工作流程。2017年,原国家食药监总局发布《关于规范医疗器械产品分类有关工作的通知》(以下简称“原分类程序”),规范了相关工作程序和要求,并提出新研制尚未列入《分类目录》的器械在省级部门提出预分类意见后,由标管中心组织审核。为进一步规范医疗器械产品分类界定工作,结合我国医疗器械产品分类界定实际情况,国家药监局组织修订了原分类程序,并发布了《关于规范医疗器械产品分类界定工作的公告》(以下简称“新分类程序”),以进一步提升和优化分类界定工作质量和效率。
相较于原分类程序主要细化完善两种不同情形的界定途径(见图1),主要变化为:
①强化申请人主体责任。医疗器械分类界定申请资料要求中明确:申请人应当明确拟申请分类界定产品的管理类别和管理属性及主张依据。强化责任相当于加强申请人“主人翁”意识,促使申请人全面思考产品技术特点和风险点,从而提高申请资料撰写质量,达到提高分类界定效率目的。②细化分类界定途径和时限,提高企业申请便捷性。新分类界定程序沿用了“新研制的尚未列入《分类目录》”和“管理类别存疑”的两条处置程序,并设定相应时限,但对于前者的界定更为严格,区分也更加明晰(见表2);改变了原本纸质材料的申请途径,实现了医疗器械分类界定申请网上受理、办理和告知的全程电子化;对于新研制产品企业直接提交器械标管中心,省去了省药监部门界定的流程,提高了企业操作效率和界定效率;此外,标管中心定期梳理汇总分类结果,提炼整理形成分类界定信息并定期公布。③分类界定结果抽查,提升省级分类界定一致性。新分类界定程序提出标管中心加强对省级药监部门分类界定工作的指导,必要时可以组织对省级药监部门回复的分类界定结果进行抽查,对于分类界定意见不一致的情形及时组织研究确定管理类别。此举不仅有利于界定标准的统一,更能维护市场的公平竞争环境。
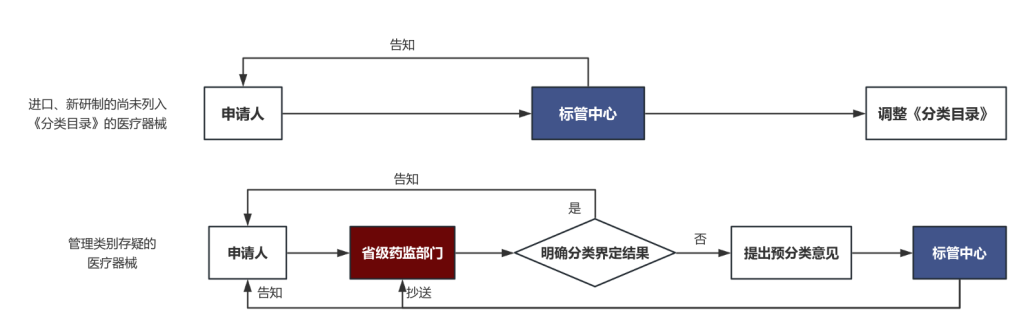
图1 新分类界定程序
来源:NMPA、中国药促会整理
表2 两条分类界定途径的产品范围变化

来源:NMPA、中国药促会整理
分类目录动态调整,适应产业发展
医疗器械批准上市后,在生产、经营、使用等方面,可能会识别到上市之前未知的风险,或是经过一定时期的监管判断产品风险可控,产品最初的分类判断可能不适应实际监管需求,因此有必要对目录实行动态调整。
为顺应科学规律,适应产业创新发展,2021年4月国家药监局发布《医疗器械分类目录动态调整工作程序》,标管中心多次发布《关于调整〈医疗器械分类目录〉部分内容的公告》,涉及60个左右的产品,其中调整了30余个产品的分类。例如,用于判断是否出现椎骨皮质穿孔的探针等由Ⅲ类降至Ⅱ类管理,用于检查眼球角膜顶突出眶缘高度的眼球突出计等由Ⅱ类降至Ⅰ类管理,用于定位、导向和保护的骨科定位导向器械等由Ⅰ类升至Ⅱ类管理,用于面部等非创伤性浅表治疗的射频浅表治疗设备等由Ⅱ类升至Ⅲ类管理。
尽管新《分类目录》已实施将近六年,当前我国医疗器械分类与国际分类结果仍有较大差异,Ⅲ类医疗器械比例25%,明显高于美国的5%(包含器械和IVD),很多产品在我国被认定为Ⅲ类,而在美国被认为是Ⅱ类。造成这一现象的原因很多,包括产业成熟度差异、监管体系等。特别是我国实行国家和地方两级审批制度,而地方政府的监管能力存在差异、各地审评标准尺度不一;我国需要及时根据产业发展配置监管资源,将资源聚焦在真正创新、真正有风险的产品上,使得监管部门与企业有更加充足的关注力及时识别、应对未知风险,还应考虑向国际规则对齐,促进监管国际化,进一步推动发展。
促进医疗器械合理分类、提升管理效率的思考
我国医疗器械分类管理一直朝向高效、科学、合理的方向努力,当前已初步构建起与国际标准接轨的医疗器械分类监管体系。但立足于监管实际,面对日新月异的医疗技术和不断变化的市场环境,构建一个更为完善、既符合国际通行标准又具备高度可行性和易操作性的分类管理体系,仍是一个需要持续投入和改进的过程。
一是建立产品全生命周期监管体系,提升医疗器械分类科学性。根据风险管理理论,风险跟踪和风险应对也是关键环节。在医疗器械的监管领域,跟踪和应对不仅是为了预防和/或处置可能对患者安全构成威胁的风险,还包括通过上市后研究/监测,全面识别产品风险,判断产品可以通过何种程度的举措控制风险,现有的风险等级评估是否准确,对风险可控研发技术成熟的产品适当降低管理类别,保障分类的合理和科学,节约行政资源。这不仅需要监管部门搭建全生命周期的管理体系,其他利益相关方也应基于自身认知对可调风险等级的产品信息积极上报至监管部门,供其参考研究。此外,尽管新分类程序有助于分类界定的一致性,但主要依靠指导和抽查,为了保障效率和准确性,国家标管中心应为最后关口,全面且及时审核省级分类界定结果的合理性。
二是加强医疗器械监管和产品的数字化与数据库建设,提高审评效率、可预测性、透明度。以信息技术为支撑,亟须建立医疗器械产品大信息系统。为促进各利益相关方查询医疗器械分类的高效与科学,建议搭建一个系统完善、全面覆盖、动态更新的医疗器械分类数据库,及时收录并更新分类界定结果,同时关联相关产品的标准、审评指南等关键信息,利于企业和监管部门快速、准确了解产品历程、判断产品分类;借助智能化的算法辅助分类实践,对比类似产品以提高准确度,例如,根据医疗器械品名系统自动匹配相似度最高的产品等信息,为医疗器械分类编码工作提供精准、便捷且高效的指导。
(感谢实习生 李心怡在本文撰写过程中的参与和支持)
审核:刘子钰、张志娟
声明:本文内容仅提供信息性参考,不构成具体市场投资建议,也不可直接作为决策内容,中国医药创新促进会不对任何主体因使用文中内容所导致的任何损失承担责任。
作者:胡萍 分析师
hup@phirda.com
15100365223(同微信)

 产业资讯
产业资讯
 医药财经
医药财经  2025-06-25
2025-06-25
 35
35

 产业资讯
产业资讯
 医药魔方
医药魔方  2025-06-25
2025-06-25
 32
32

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-06-25
2025-06-25
 34
34