 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2024-06-06
2024-06-06
 1550
1550
鉴于制药行业的复杂性、全球性和多样性,不同国家监管机构通常有不同的科学和监管要求,医药企业需要分别满足这些要求才能获得产品批准,这可能导致重复的监管工作,既增加将产品推向市场的成本和时间,也影响患者可及。同时,并非所有监管机构均拥有确保批准上市产品安全性、有效性的资源配置,据WHO统计显示,其71%的成员国不具备独立审评药品的能力。
因此,在长期应对全球复杂监管环境带来的挑战工作中,越来越多监管机构逐步认识到无论监管机构的规模和监管能力如何,协调各地区的监管要求,促进国际协同、信赖始终是其加强全球监管体系能力和效率建设最核心、有效的战略方法。纵观全球,主要有3种力量推动着国际监管协同。一是以WHO规则为主导的国际监管协同;二是区域间监管协调实践;三是以ICH、PIC/S等国际通用规则为基础的监管能力提升与监管标准对话。在当前国际准入实践中常被运用的严格监管机构(Stringent Regulatory Authority,SRA)概念正是来源于WHO。
以具有相当潜力、极具开发价值的东盟医药市场为例,东盟国家药品监管整体呈现“碎片化”“差异性大”的特性,给企业带来了巨大准入挑战,但东盟国家即使在监管能力相对较高,能够独立审批的东盟6国,也多参考美国、欧盟及其他WHO界定的SRA监管决策结果。
随着国际监管合作的持续深化,国际监管协调组织、各国家监管机构对国际监管协同的认识也走入了新的阶段,新的国际认可机遇也在不断涌现,作为后入局者,中国不仅要在管理措施和监管要求上向国际标准看齐,更要加快推动中国融入全球监管体系,以监管国际化推动产业国际化,助力中国生物医药产业经济在世界舞台上绽放。
为此,中国医药创新促进会政策研究中心设立了“中国创新药出海技术路径研究”专题,以推动有利于国产创新药出海政策的出台、推进达成药品监管注册技术路径和标准共识、建立与重点国家从多边或双边的沟通合作机制为主要目标,开展了一系列研究。研究取得了丰硕的成果,现与各位读者分享推动中国创新药出海政策建议,共同为中国医药创新事业出谋划策。
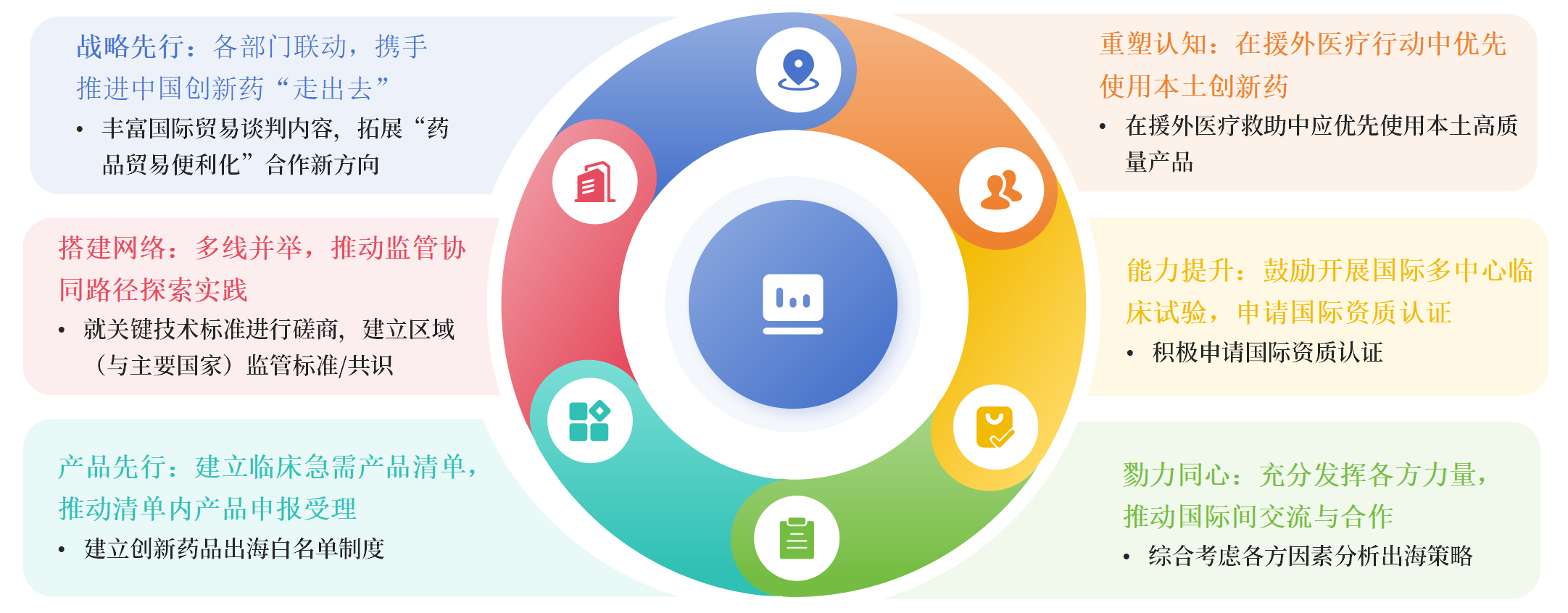
推动中国创新药出海相关技术路径建议


 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 110
110

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 98
98

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 87
87