 研发追踪
研发追踪
 凯莱英药闻
凯莱英药闻  2024-06-07
2024-06-07
 3156
3156
近日,吉利德(“Gilead”)在2024年欧洲肝脏研究协会(EASL)大会上公布了在研药物seladelpar治疗原发性胆汁性胆管炎 (PBC) 的两年中期分析数据,该分析纳入了此前参加过seladelpar传统临床研究和关键性3期RESPONSE注册研究的PBC受试者,结果显示:使用seladelpar治疗后,患者的胆汁淤积的指标得到改善,炎症也有所减轻;其他研究结果表明,seladelpar有助于减轻PBC患者的瘙痒症状。
2024年3月,吉利德以32.5 美元/股的价格全现金收购Cymabay Therapeutics,总对价为43 亿美元,获得公司核心管线药物seladelpar。Seladelpar是一款过氧化物酶体增殖物激活受体(PPAR)激动剂,本次的长期疗效和安全性中期结果表明,seladelpar有望改变PBC患者的治疗前景,是一种潜在“同类最佳”产品。
该药物用于治疗对熊去氧胆酸(UDCA)反应不足或不耐受的无肝硬化或代偿性肝硬化(Child-Pugh A)成人原发性胆道炎(包括瘙痒)的新药申请(NDA)已被FDA受理且纳入优先审查,PDUFA日期为2024年8月14日。此外,英国药品和健康产品管理局(MHRA)和欧洲药品管理局(EMA)也已接受seladelpar的上市审评。
关于ASSURE研究的中期分析数据
ASSURE是一项开放标签研究,旨在评估seladelpar对PBC患者的长期安全性和耐受性,这些受试者此前已经参加过seladelpar的其他临床研究;此外,ASSURE还将评估seladelpar对PBC患者生活质量的影响,包括胆汁淤积性肝病皮肤瘙痒等重要指标。结果显示:
在参与此前传统研究的已接受24 个月seladelpar 治疗的 99 名受试者中,70%达到了综合反应终点,包括碱性磷酸酶 (ALP) 水平低于正常上限 (ULN) 的 1.67 倍、ALP 水平下降至少 15% 以及总胆红素 (TB) 水平等于或低于 ULN。有 42% 的受试者在 24 个月时实现了 ALP 正常化。
在参与此前传统研究的已接受12 个月seladelpar 治疗的 164 名受试者,73%实现了具有临床意义的综合反应终点,其中 42% 实现了ALP正常化。
在参与RESPONSE研究12个月后继续参加 ASSURE 研究,即连续接受 seladelpar 治疗共18 个月的受试者中,62% 达到了综合反应终点,33% 达到了 ALP 正常化;对于连续接受24个月seladelpar治疗的参与者(n=29),分别有 72% 和 17% 达到了综合反应终点和 ALP 正常化。
在参与RESPONSE 研究先前随机接受安慰剂治疗的 52 名受试者中,75% 达到了综合反应终点,27%的受试者交叉接受 seladelpar 治疗六个月后实现了 ALP 正常化。经过 12 个月的治疗,94% 的交叉受试者达到了综合反应终点,50% 达到了 ALP 正常化(n=16)。
药物长期服用耐受性良好,没有发生与治疗相关的严重不良事件。
此外,采用数字评分量表 (NRS;0-10)收集了患者报告的瘙痒情况:在基线 NRS≥4 的受试者中,观察到瘙痒持续改善。其中,在传统研究中的受试者中,12 个月和 24 个月时平均减少3.8 分和 3.1 分;在 RESPONSE 受试者中,连续使用seladelpar 治疗和以前采用安慰剂治疗的受试者在六个月时平均减少 3.8 分。
在肝硬化受试者中,2 名患有代偿性肝硬化的参与者已完成 12 个月的治疗;其中56%(18/32)在第 12 个月达到综合生化终点,47%(15/32)的受试者ALP 恢复正常。未发生与研究药物相关的严重不良事件。
关于Seladelpar
Seladelpar 为一在研、口服、潜在强效选择性PPAR β/δ激动剂,曾于2019 年2月获得美国FDA授予突破性疗法认定,用以治疗PBC。
2023年9月,CymaBay公布了关键性3 期RESPONSE试验的积极结果,该试验评估seladelpar用于PBC成人患者的安全性和有效性。结果显示:
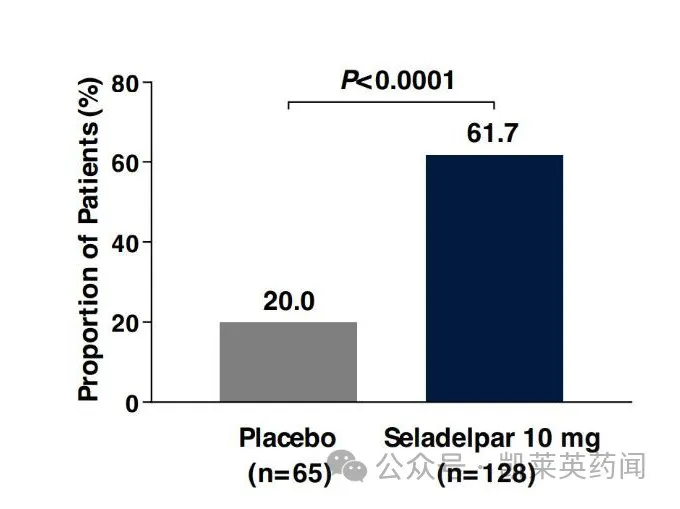
共有61.7%的10 mg seladelpar组患者(n=128),在12个月时达到血清碱性磷酸酶和胆红素相关的主要复合终点,此数值在安慰剂组为20.0%(n=65,p<0.0001)。在12个月时,seladelpar组与安慰剂组患者分别有25.0%与0%的碱性磷酸酶达正常化(关键次要终点,p<0.0001),支持seladelpar具抗胆汁淤积作用。Seladelpar组碱性磷酸酶的最小二乘平均百分比降低为42.4%,而安慰剂组为4.3%(p<0.0001)。
在6个月后,与安慰剂相比,接受seladelpar治疗的患者其瘙痒(关键次要终点)在统计学上显著减少。在那些数字评估量表(NRS)基线值≥4(中度至重度瘙痒)的患者中,接受seladelpar治疗患者的瘙痒NRS最小二乘平均降低3.2分(n=49),而安慰剂组则降低1.7分(n=23,p<0.005)。
关于PPAR激动剂
PPARs是一类由配体激活的核转录因子,包括PPARα、PPARβ/δ和PPARγ 3种类型。PPARs作为脂质代谢、葡萄糖稳态和炎症的重要调节因子,已成为NASH治疗的潜在靶点。PPARα在肝脏中高表达,调节脂肪酸的转运和氧化;因此PPARα的活性降低会导致脂肪酸的合成分解异常,加重肝脏的脂质的沉积。PPARβ/δ和PPARγ参与巨噬细胞的功能调控,激活后可使巨噬细胞由M1(促炎)表型向M2(抗炎)表型转化,从而减轻肝脏炎症。
临床前数据表明,PPARβ/δ对调控胆汁酸合成、炎症、纤维化过程的多种基因有调节作用。据不完全统计,目前在研的PPARβ/δ激动剂约30余种。

关于PBC
PBC是一种罕见的慢性炎症性肝病,主要影响40岁以上的女性(千分之一)。PBC的特点是胆汁流动受损(称为胆汁淤积)和肝脏中有毒胆汁酸的积累,导致肝脏内胆管的炎症和破坏,并导致碱性磷酸酶(ALP)和总胆红素水平升高。PBC最常见的早期症状是瘙痒(瘙痒)和疲劳,其进展可导致肝癌和肝脏相关死亡率的增加。
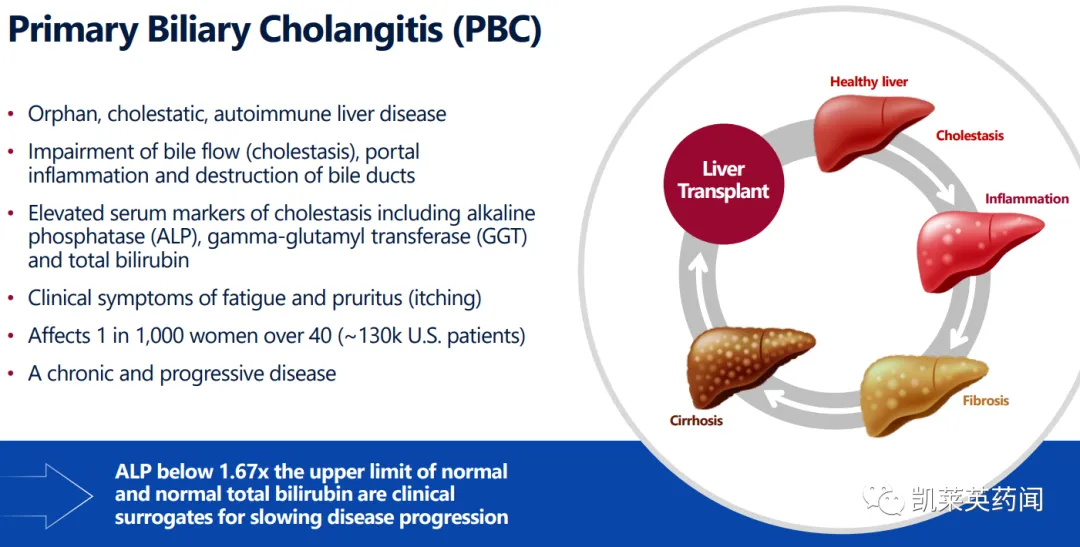
PBC呈全球性分布,可发生于所有的种族和民族;据文献报道,年发病率为0.33/10万~5.8/10万,患病率为1.91/10万~40.2/10万,其中北美和北欧国家发病率最高,美国约有13万PBC患者,40岁以上女性患病率约为千分之一。
Coherent Market Insights报告显示,2017年全球PBC治疗市场规模为5.26亿美元,未来10年复合增长率将保持在36.3%,到2026年达到惊人的85.93亿美元。
PBC治疗市场规模(单位:亿美元)

早期治疗对改善患者生活质量,延长患者生命至关重要。目前,已正式获批PBC适应症的仅有两个药,即熊去氧胆酸和奥贝胆酸,熊去氧胆酸是治疗PBC的一线用药,但约有40%的患者不应答,奥贝胆酸为二线用药可单药或联合熊去氧胆酸治疗,但约50%患者对奥贝胆酸不应答,奥贝胆酸还可引起严重瘙痒等不良反应,严重降低患者生活质量。
关于吉利德在肝病领域的布局
据吉利德财报,2023年HIV及肝炎类产品分别带来了181.75亿美元、27.84亿美元收入,合计贡献了约77.3%营收份额,是吉利德较为重要的业务版块。
据不完全统计,目前吉利德在肝病领域共布局约50余款药物。

近年来,公司频繁通过交易,加强肝病领域药物布局。


 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 25
25

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 25
25

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 21
21