 研发追踪
研发追踪
 医药魔方
医药魔方  2024-06-24
2024-06-24
 2940
2940
6月20日,强生宣布古塞奇尤单抗(商品名:Tremfya)皮下注射(SC)剂型诱导治疗中重度活动性克罗恩病(CD)成年患者的III期GRAVITI研究取得了积极结果。基于该研究和两项头对头III期研究(GALAXI 2和GALAXI 3)的积极结果,强生已向FDA递交古塞奇尤单抗治疗CD的上市申请。

GRAVITI研究是一项随机、双盲、安慰剂对照临床试验,评估了古塞奇尤单抗(SC)诱导治疗对常规治疗(即皮质类固醇或免疫调节剂)或生物制剂(TNF 拮抗剂或维得利珠单抗)反应不足或无法耐受的中重度活动性CD患者的疗效和安全性。研究的主要终点为第12周实现临床缓解的患者比例和实现内镜应答的患者比例。
结果显示,治疗第12周,古塞奇尤单抗(SC)组患者的临床缓解率和内镜应答率明显高于安慰剂组。
今年4月,古塞奇尤单抗SC剂型对比乌司奴单抗的两项头对头III期研究(GALAXI 2和GALAXI 3)也达到了优效性终点。
GALAXI系列研究是一项随机、双盲、安慰剂和阳性药物对照II/III期试验,评估了古塞奇尤单抗对比乌司奴单抗和安慰剂诱导治疗和维持治疗对常规疗法(皮质类固醇或免疫调节剂)和/或生物制剂(TNF 拮抗剂或维多珠单抗)反应不足或不耐受的中重度活动性CD患者的疗效和安全性。
该研究包括两个阶段,阶段1为II期研究(GALAXI 1研究),旨在确定合适的诱导剂量和维持剂量;阶段2为III期研究(GALAXI 2和GALAXI 3研究),旨在验证古塞奇尤单抗的疗效和安全性。阶段2的主要终点为第12周实现临床缓解的患者比例和第48周实现内镜应答的患者比例。
结果显示,在内镜应答终点方面,古塞奇尤单抗组优效于乌司奴单抗组。
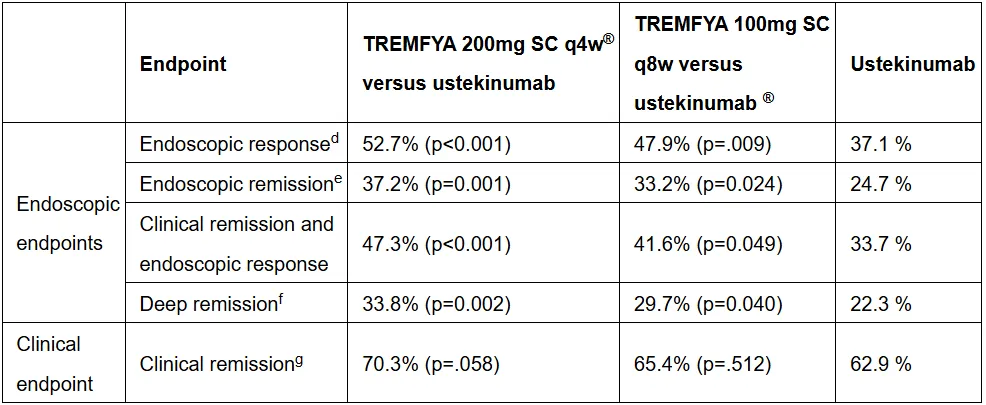
来源:消化道疾病周2024大会
这也是第一项证明古塞奇尤单抗在内镜应答方面优效于乌司奴单抗的注册性双盲头对头临床试验。强生已基于此向欧洲药品管理局(EMA)提交古塞奇尤单抗治疗CD的上市申请。古塞奇尤单抗有望成为唯一一款SC剂型或静脉注射(IV)剂型均可作为诱导治疗方案的IL-23抑制剂。

 研发追踪
研发追踪
 医药魔方Pro
医药魔方Pro  2025-07-14
2025-07-14
 151
151

 研发追踪
研发追踪
 药明康德
药明康德  2025-07-14
2025-07-14
 152
152

 研发追踪
研发追踪
 药明康德
药明康德  2025-07-14
2025-07-14
 166
166