 研发追踪
研发追踪
 RNA前沿
RNA前沿  2024-07-01
2024-07-01
 1499
1499
2024年6月24日,Alnylam Pharmaceuticals宣布了其HELIOS-B 3期临床研究的积极顶线结果,该研究针对的是vutrisiran,这是一种用于治疗伴有心肌病的ATTR淀粉样变性 (ATTR-CM) 的在研RNAi治疗药物。
该研究达到了主要终点,表明在双盲期间,总体人群 (HR 0.718,p值 0.0118;n=654) 和单药治疗人群 (基线时未接受他法米迪治疗的患者;HR 0.672,p 值 0.0162;n=395) 的全因死亡率和复发性心血管 (CV) 事件的综合发生率均显着降低。
研究还显示,总体和单药治疗人群的所有次要终点均有显著改善。这包括疾病进展的关键指标:6 分钟步行测试 (6-MWT)、堪萨斯城心肌病问卷 (KCCQ) 和第 30 个月的纽约心脏协会 (NYHA) 分级 (所有 p<0.025)。重要的是,使用 vutrisiran 治疗还降低了总体人群 (HR 0.645,p<0.025) 和单药治疗人群 (HR 0.655,p<0.05) 的全因死亡率,直至第 42 个月。这是一项预先指定的意向治疗分析,包括开放标签扩展中长达六个月的数据。
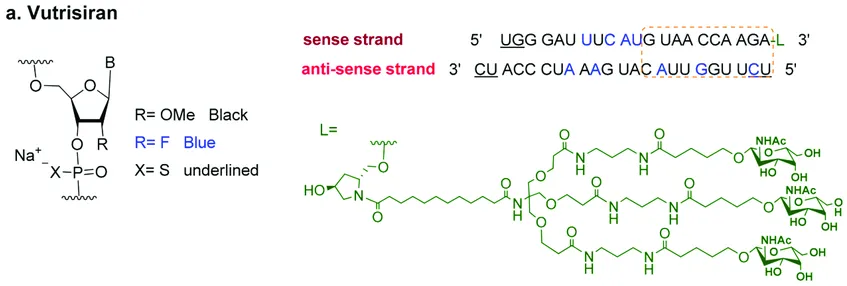
Vutrisiran的化学结构此外,vutrisiran 对所有关键亚组的主要综合终点和所有次要终点均表现出一致的效果,包括基线 tafamidis 使用情况、ATTR 疾病类型和疾病严重程度测量。
在 HELIOS-B 研究中,vutrisiran表现出令人鼓舞的安全性和耐受性,与其既定特性一致。vutrisiran组和安慰剂组的不良事件 (AE)、严重AE和导致研究药物停药的AE发生率相似。与安慰剂组相比,vutrisiran组的AE发生率未见≥3%。
HELIOS-B (NCT: NCT04153149) 是一项3期、随机、双盲、安慰剂对照的多中心全球研究,旨在评估vutrisiran在总体和单一治疗人群中降低全因死亡率和复发性心血管事件(作为主要综合终点)对ATTR淀粉样变性心肌病患者的疗效和安全性。该研究随机选择了655名患有ATTR淀粉样变性(遗传性或野生型)心肌病的成年患者。患者按1:1的比例随机分配接受vutrisiran 25mg或安慰剂皮下注射,每三个月一次,双盲治疗期长达36个月。双盲期结束后,所有符合条件的剩余研究患者均可在开放标签延长期内接受vutrisiran治疗。
Alnylam计划2024年底开始进行全球监管提交,包括使用优先审查凭证向美国食品药品管理局提交补充新药申请。
英文链接:https://investors.alnylam.com/press-release?id=28231

 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2025-04-28
2025-04-28
 223
223

 研发追踪
研发追踪
 细胞基因治疗前沿
细胞基因治疗前沿  2025-04-28
2025-04-28
 225
225

 研发追踪
研发追踪
 药视点
药视点  2025-04-28
2025-04-28
 230
230