 产业资讯
产业资讯
 写意宣发
写意宣发  2024-07-05
2024-07-05
 1517
1517
作为有着全球5500万患者的阿尔茨海默病和相关失智症的疾病,这个领域内可用之药非常稀缺,而且大部分药物都只是针对病症进行的“围城打援”式的疾病管理。真正针对病因开发的疗法,在Donanemab获批之前可用的只有渤健/卫材的Leqembi(lecanemab)。渤健备受争议的阿尔茨海默病单抗疗法Aduhelm(Aducanumab)已于今年退市,已接受Aduhelm治疗的患者的可用时间只到今年11月1日。
另一方面,阿尔茨海默病患者的人数在不断攀升之中,目前美国患者人数超过700万人,预计2060年将达到1390万人左右(图1)。在市场上针对阿尔茨海默病潜在病因疗法只剩下Leqembi的情况下,大量患者迫切需要新疗法的问世。
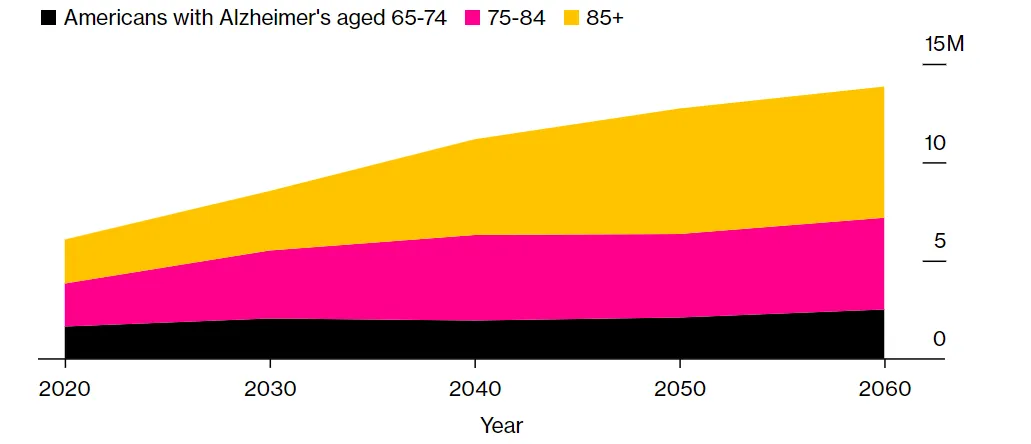
图1. 美国阿尔茨海默病患者人数走势图。(图片来源:Bloomberg)
一波三折的Donanemab获批
就在这个几乎无药可用的当口,备受关注的礼来阿尔茨海默病新药donanemab的获批为患者芸芸的阿尔茨海默病治疗带来的新的希望。然而donanemab的获批却经历了一波三折的“好事多磨”,FDA甚至动用了咨询委员会会议来评估donanemab的上市命运。
天将降大任于斯药的donanemab最终在7月2日修得正果,获得了FDA的监管批准,成为市场上第二款针对阿尔茨海默病的药物,礼来将其donanemab命名为Kisunla。
为了这一历史性时刻,礼来耗费了35年80亿美元,有超过1万名患者参与了相关临床试验。虽然获得了监管部门的认可,但FDA为donanemab添加了ARIA风险的黑框警告,并表示具有两个APOE4基因变体拷贝的人更有可能出现这些副作用。该标签建议医生在开始治疗之前对患者进行这种基因变异的检测。但FDA标签不包括测量tau的要求。FDA标签支持在试验中测试的剂量,如果PET成像上的淀粉样斑块减少到最低水平,医生可以考虑停止治疗。
礼来为350 mg一瓶的Kisunla标价696美元,疗程的总体费用将取决于患者的治疗时间。在前三个月,患者每四周静脉注射 700 mg,之后每四周给药1400 mg。这意味着六个月的治疗费用为 12522 美元,为期一年的治疗费用为 32000 美元,18 个月的治疗费用为 48696 美元。礼来认为,如果淀粉样斑块被清除,可以停药的属性将使Kisunla成为一种具有成本效益的选择。
然而donanemab撞线之前的冲刺却遭遇了FDA的“冷处理”。FDA似乎对于之前“痛快”批准但上市后表现不佳的两款渤健/卫材的阿尔茨海默病单抗药物Aduhelm和Leqembi仍然心有余悸。Aduhelm出师未捷身先死,Leqembi功效饱受争议,FDA故而对“师出同门”的donanemab心存疑虑,选择在PDUFA日期之前召开咨询委员会会议。
FDA对于donanemab的质疑主要集中在两方面:1)是否应该根据PET扫描(正电子发射断层扫描)中显示的tau蛋白水平来限制接收该药物的患者?礼来在临床研究中使用tau蛋白作为关键标准来判断患者是否可以入组;2)使用donanemab的潜在风险如何与其益处相比?FDA提到了一项分析,尽管该分析存在数据缺失,但它可能表明接受该药物的患者有更高的死亡风险。
FDA召开咨询委员会会议的做法本身就已经令行业内部感到意外,鉴于FDA对渤健/卫材药物Leqembi的流畅批准,业界认为donanemab也应享有同样的审批待遇。在礼来公司的主要三期临床试验中,根据iADRS调查(结合了认知和功能的衡量指标,如驾驶、管理财务或进行对话),donanemab显示出与安慰剂相比,疾病进展减缓了35%。使用传统的CDR-SB调查,donanemab相对于安慰剂显示出认知衰退减缓了36%(表1)。
为了被纳入第 3 阶段研究,入组患者需要在阿尔茨海默病的两项指标上呈阳性:他们的大脑必须在 PET 扫描中对淀粉样蛋白(amyloid)呈阳性,淀粉样蛋白被认为是阿尔茨海默病病理的一部分,也是 donanemab 的靶点。同 Leqembi 的试验不同,donanemab 试验中的患者还必须对tau 的蛋白质检测呈阳性,tau蛋白被认为是阿尔茨海默病严重程度的标志。没有或非常低 tau 水平的患者未被纳入研究的主要分析,因为研究人员认为他们在试验期间不会表现出足够大的疾病进展。
研究中的大部分人群的 tau 水平处于低到中等水平,而且似乎这一组比那些 tau 水平高的人受益更多,这个发现也成为了FDA关注的内容。礼来称其数据显示,无论 tau 水平如何,donanemab都是有效的。然而FDA 担心疗效的条件性,是否应该仅限于试验中测试的人群范围。FDA 的审查指出,“低tau 水平的患者可能更有可能从抗淀粉样蛋白治疗中受益”,但由于他们的病情进展较慢,治疗效果可能需要更长时间才能显现。
FDA 提出的另一个问题是关于 donanemab 的安全性。Donanemab 和 Leqembi 等药物具有已知的严重副作用:它们会增加淀粉样蛋白相关成像异常 (ARIA) 的风险,这种异常可能表现为脑肿胀和脑出血。FDA 指出,一项分析显示,在对 3 期试验的初步分析中,donanemab 组的死亡人数几乎是安慰剂组的两倍(donanemab 组死亡 17 人,而安慰剂组死亡 10 人),但许多退出研究的患者的后续数据缺失。
据 FDA 称,礼来使用第三方供应商收集了这些缺失患者的进一步数据。将这些数据添加到初步试验分析中,死亡率差异明显缩小(礼来在其自己的简报文件中提供了最新数据,称 donanemab 组有 20 人(2%)死亡,安慰剂组有 17 人死亡(1.7%)),但服用该药物的患者的死亡风险仍然略高。但FDA认为,临床研究中死亡似乎与 donanemab 没有因果关系。
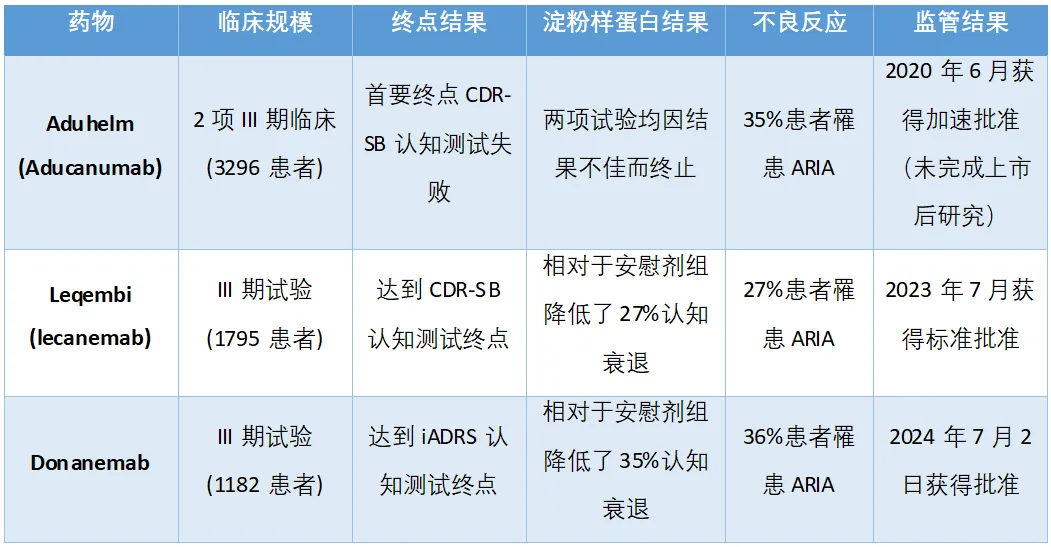
表1. 靶向β-淀粉样蛋白的阿尔茨海默病疗法对比
尽管FDA的外部专家在咨询委员会会议之前表达了出了种种疑虑,但现在来看可能都是天将降大任于斯人之前的劳其体肤。原本以为会出现胶着的咨询委员会会议最终以11票赞成0票反对的雷霆之势收尾。最终FDA顺应了咨询委员会的决定,做出了批准donanemab的监管决定,而且是标准批准。Donanemab获得了FDA的快速通道、优先审评和突破性疗法认定。
FDA认为donanemab疗法减缓患者认知下降的能力超过了其安全风险的裁定,可以治疗阿尔茨海默病导致的轻度认知障碍的广大人群。
鉴于Leqembi的获批上市,作用机制相似的donanemab的命运其实并不令开发者过于担心。只是FDA召开咨询委员会会议,并且推迟做出监管决定的做法有些令人意外。FDA关注的其实是符合接受donanemab的患者标准的问题。FDA 要求小组成员讨论是否应将donanemab的使用限制在脑蛋白 tau 达到一定水平的患者身上。Tau 水平为零或低的患者被排除在donanemab的试验之外,但他们被纳入了一项补充研究,根据生物标志物测量结果,他们在研究中经历了积极的治疗反应。
一些顾问对于将低tau水平患者排除在临床研究之外的做法表示担心,但许多人表示,补充研究中的生物标志物数据让他们感到放心,而且在现实生活中对患者进行 tau 扫描将非常困难,因此不应要求对 tau 进行评估。FDA最终对donanemab设定的标签不需要进行tau蛋白的测量。
虽然专家委员投票认为这些药物的总体益处大于风险,但他们确实对一小部分拥有两个 APOE4 基因变体副本的患者的风险表示担忧,因为他们更有可能在淀粉样蛋白清除治疗中出现脑肿胀的副作用。FDA在donanemab的标签中建议医生在开始治疗之前对患者进行这种基因变异的检测。
除此之外,专家委员对礼来的试验设计提出了质疑。礼来在试验过程中在淀粉样斑块清除达到阈值后停止了对患者的治疗。专家们表示,虽然这是一种创新方法,但在现实生活中如何实施仍存在不确定性。例如患者停药后治疗效果能持续多久,患者应该多久接受一次检测以确定是否需要重新开始治疗。对此,FDA对donanemab的剂量表示认可,并接受如果PET成像上的淀粉样斑块减少到最低水平,医生可以考虑停止治疗。
在donanemab获得FDA批准之后,治疗早期阿尔茨海默病患者的医生首次拥有了治疗选择。Donanemab 每月通过静脉输注给药一次,Leqembi则需要每两周输注一次。然而,卫材和渤健已经开发出一种新型 Leqembi,可以通过更方便的皮下注射给药。Donanemab 在其试验中显示出比 Leqembi 更高的疗效,但礼来药物也显示出更高的脑肿胀和脑出血率。两款药物在早期阿尔茨海默病领域的竞争将成为这个行业最大的焦点之一。
Donanemab命运对于行业的影响
FDA 咨询委员会对donanemab高度一致的赞同决定将对多年来裹足不前的阿尔茨海默疗法开发领域产生至关重要的影响。
根据 PhRMA 2018 年的一份报告,从 1998 年到 2017 年,阿尔茨海默病药物开发的成功率仅为 2.7%。这个低通过率背后是哀鸿遍野的146 次失败的临床研究。而通过FDA监管审批的四种阿尔茨海默病疗法也只是“隔靴搔痒”地治疗阿尔茨海默病的相关症状,这种愁云惨淡的氛围令广大的患者群体无法得到有效的治疗。
在donanemab获批之前,FDA只批准了两种看上去明心见性地治疗阿尔茨海默病的单抗疗法,即渤健与卫材联合开发的Aduhelm和Leqembi。Aduhelm的历史人尽皆知,顶着巨大的争议亮相,最终也在持续的质疑声中主动退市、草草收场,留下了一份兴勃亡忽的药物开发史。因此从现状来看,阿尔茨海默病疗法市场在donanemab之前仅仅由Leqembi苦苦支撑。
抗淀粉样蛋白疗法开发
获得批准的donanemab 将扩大抗淀粉样蛋白药物的可及性和选择性,成为未来几代药物的基石。虽然抗淀粉样蛋白疗法不是灵丹妙药,但它们为患者提供了改变疾病进程的机会,为更新疗法的开发争取时间和经验。Leqembi和donanemab针对的都是阿尔茨海默病早期患者,因此如果能在诊断方面实现突破,尽早诊断出潜在的患者,这两款药物将会产生更显著的功效。
然而业内也有对抗淀粉样蛋白疗法的质疑声音,认为此疗法对于患者认知功能的影响并不显著。因此,随着抗淀粉样蛋白药物不断地产生更多的真实世界数据,其生物学机制理解和有效性评估无疑将更加完善与严谨。除了渤健/卫材与礼来之外,生物制药和科技公司仍然在深挖抗淀粉样蛋白和抗tau蛋白疗法治疗阿尔茨海默病的潜力。
虽然aduhelm商业失败,但渤健仍然在针对这款单抗药物进行两项阿尔茨海默病的后期临床研究(AHEAD 3-45),希望进一步将淀粉样蛋白的清除与认知衰退的减少联系起来。礼来的两款抗淀粉样蛋白资产remternetug 和 solanezumab已经进入III期临床,它们都是清除淀粉样蛋白的单抗药物。但solanezumab似乎无法清除斑块或减缓认知能力下降。
也有一些公司通过小分子模态开发清除淀粉样蛋白药物。例如 Alzheon(valiltramiprosate) 和 Cassava Sciences (simufilam),这两家公司都在研发后期候选药物。它们有望成功历史上首批口服阿尔茨海默病抗淀粉样蛋白药物(图2)。
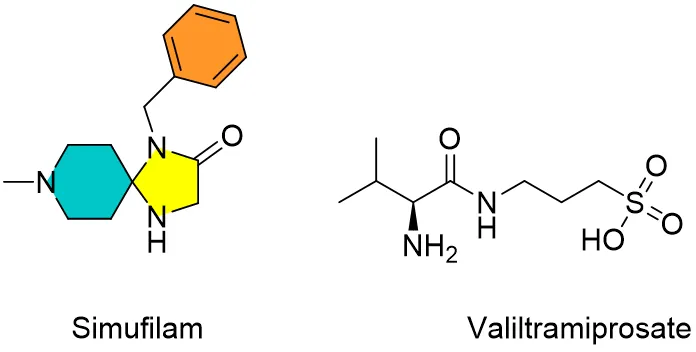
图2. 小分子抗淀粉样蛋白阿尔茨海默病候选药simufilam和valiltramiprosate化学结构。
Tau蛋白清除带来的思考
既然donanemab将tau蛋白摆在了桌面上,这就说明它有可能成为新一代阿尔茨海默病疗法的靶点。实际上,大型制药公司对开发清除大脑中 tau 蛋白疗法的热情也的确持续高涨。
Tau蛋白聚集纠缠是阿尔茨海默病的另一个特征。Tau蛋白的异常磷酸化和神经纤维缠结是阿尔茨海默病的特征性病变之一。一方面研究人员正在探索tau蛋白作为神经退行性疾病的生物标志物,以便早期诊断和监测疾病进展。另一方面,阻止tau蛋白异常磷酸化或促进其清除成为治疗神经退行性疾病的潜在策略。
罗氏、百健、卫材、强生和礼来等制药巨头都在临床试验中研发了抗 tau蛋白候选药物。与淀粉样蛋白清除类似,这些候选药物旨在分解 tau 蛋白。罗氏在阿尔茨海默病的后期治疗中多次遭遇失败,目前正与优时比合作,将其抗 tau 候选药物推进至第二阶段。百健、卫材、强生和礼来也已进入正在进行的中期试验。
但抗 tau 蛋白理论同样面临着与抗淀粉样蛋白类似的挑战。尽管一些大型制药商仍在尝试使抗 tau 发挥作用,但一系列的失败让研究人员不得不暂停单纯地清除这些致病蛋白的努力,而是思考淀粉样蛋白和tau蛋白在患者大脑中聚集形成沉淀物的原因。
阿尔茨海默病诊断技术急需突破
上文提及,Leqembi和donanemab针对的都是早期阿尔茨海默病患者,这种现状对于阿尔茨海默病的早期精确诊断提出了非常高的要求。疾病治疗,至少是阿尔茨海默病这种神经退行性疾病,目前不存在“沉舟侧畔千帆过,病树前头万木春”的可能性。错过了最佳诊断时间,leqembi和donanemab的功效将大打折扣,甚至失去了为中晚期患者开具处方的机会。
今年在多伦多举行的 2024 年核医学和分子成像学会 (SNMMI) 年会中,许多发言人讨论了 donanemab 和其他抗淀粉样蛋白药物,以及正确诊断阿尔茨海默病的迫切需要。在抗淀粉样蛋白药物问世之后,脑部病变的成像至关重要。
临床诊断阿尔茨海默病非常困难,即便在最专业的失智中心,也存在超过四分之一的阿尔茨海默病误诊率。正电子发射断层扫描 (PET) 是诊断和治疗阿尔茨海默病的一个非常重要的组成部分。Donanemab 疗法通过 PET 测量,显示出对脑淀粉样斑块基线变化具有统计学意义。FDA认为,使用 PET 上淀粉样斑块减少作为替代终点很可能预测早期阿尔茨海默病患者的临床益处。然而PET的高成本和保险覆盖可能成为推广这项技术的瓶颈因素。
Donanemab市场前景看好
尽管donanemab获批时间较晚,但业内人士颇为看好这款药物将后发先至,超越渤健和卫材成为阿尔茨海默病领域的领导者。
Bloomberg分析师预计,到 2030 年礼来将后来居上,占据价值 130 亿美元的阿尔茨海默病市场的半壁江山。Leqembi在经历了低迷的开局后,其销售额轨迹开始出现快速抬头趋势。今年 5 月,卫材预计Leqembi在2024 财年的销售额将升至约 3.64 亿美元(卫材2024财年将于 2025 年 3 月结束)。
然而Bloomberg分析师预测,从长远来看,Leqembi的先发优势将无法确保其在销售排行榜上“既寿永昌”。Bloomberg分析师预测,如果donanemab获得批准,其销量可能在 12 个月内便超过 Leqembi。部分原因是donanemab用药更方便,而且一旦淀粉样蛋白水平达到清除阈值,患者就可以停止服用该药物。
Bloomberg分析师预测礼来将在 2030 年成为阿尔茨海默病领域的主导者。Donanemab 及其礼来在研的新一代自我注射药物remternetug(N3pG-Abeta mAb) 可能在 2030 年产生 65 亿美元的收入,是 Leqembi 预测的 32 亿美元收入的两倍多,但卫材此前曾经做出过Leqembi 2032年销售量将近90亿美元的预测,不过卫材的预测包括一些临床前阿尔茨海默病的销售额。Bloomberg 指出,如果药物适用患者群体扩展到无症状人群,销售额将远高于其预期。
Donanemab相对于Leqembi的一个明显优势在于用药的便利性。Leqembi使用者要在 18 个月的疗程内接受 38 次输液,而且每位患者首先需要进行 PET 脑部扫描和定期 MRI 扫描以检查肿胀,这会对五分之一的患者产生副作用。雪上加霜的是,Medicare拒绝为他们覆盖的 3080 万 65 岁以上老人支付昂贵的扫描费用,而且一些神经科医生选择不开具Leqembi处方,因为他们认为Leqembi的风险收益比并无优势。
Leqembi 目前的年费为 26500 美元,也是FDA 20 年来全面批准的第一款带有黑框警告的药物。尽管如此,鉴于 700 万美国人和全球超过 5000 万人患有阿尔茨海默病,分析师预测Leqembi和donanemab的销量都将实现显著增长(尽管donanemab尚未获得正式批准)。Bloomberg预测,到 2030 年,Leqembi 和 donanemab 预计每年将分别创造 22 亿美元和 55 亿美元的收入。
参考文献:
1.Herper, M. et al. FDA reviewers ask if approval of Lilly’s Alzheimer’s drug should be restricted to a smaller group. STAT. 06. 06. 2024.
2.Medications for Memory, Cognition and Dementia-Related Behaviors. Alzheimer’s Association. Retrieved on 09. 06. 2024.
3.Taylor, N. P. Eli Lilly tipped to leapfrog Eisai, Biogen and take control of $13B Alzheimer's market. Fierce Pharma. 07. 06. 2024.
4.Langreth, R. et al. New Alzheimer’s Drug Is First to Show It Slows Disease. But It’s Facing a Rocky Rollout. Bloomberg. 13. 07. 2023.
5.Garde, D. et al. FDA Staff Proposes Narrow Approval for Lilly Alzheimer Drug. Bloomberg. 06. 06. 2024.
6.Alzheimer’s drug Leqembi falls short of blockbuster status in faltering US rollout. Financial Times. 22. 04. 2024.
7.Chen, E. et al. FDA advisers unanimously recommend approval of Eli Lilly’s Alzheimer’s disease treatment. STAT. 10. 06. 2024.
8.Imbimbo, B. P. et al. Initial failures of anti-tau antibodies in Alzheimer's disease are reminiscent of the amyloid-β story. Neural Regen Res. 2023. 18, 117-118.
9.Gibney, M. Lilly’s adcomm win shows amyloid and tau will likely dominate Alzheimer’s — for now. Pharma Voice. 13. 06. 2024.
10.Slabodkin, G. With Donanemab on the Cusp of Approval, Proper Alzheimer’s Diagnosis Is Urgent. Biospace. 14. 06. 2024.
11.Chen, E. et al. FDA approves Eli Lilly’s early Alzheimer’s treatment. STAT. 02. 07. 2024.

 产业资讯
产业资讯
 医药投资部落
医药投资部落  2025-09-20
2025-09-20
 18
18

 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2025-09-20
2025-09-20
 15
15

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-09-20
2025-09-20
 18
18