 产业资讯
产业资讯
 佰傲谷BioValley
佰傲谷BioValley  2024-07-12
2024-07-12
 718
718
近日(7月9日),开发艾滋病的Biotech CytoDyn宣布已经解决了和前CRO合作伙伴Amarex Clinical Research的诉讼。
这两家企业本该是亲密无间的合作伙伴,连续合作8年相安无事,但在一系列事件揭露后,两家企业大难临头各自飞,最终对簿公堂,要求赔偿不菲的损失。
依据现有的和解条款,Amarex需要向CytoDyn支付1200万美元,其中1000万美元将在和解协议签署后支付,其余200万美元将在和解协议签订后的12个月内支付,Amarex 将提供650万美元的保证金。而Amarex要求CytoDyn支付的1400万美元应付账款则遭到了取消。
本文将对整起事件的来龙去脉进行简单介绍。
两位CEO合谋欺上瞒下
CytoDyn本身开发的新药管线是是一类CCR5拮抗剂leronlimab,是2018年从知名科学家Richard G. Pestell创立的ProstaGene中收购获得的管线,机制机理也很明确,就是通过拮抗CCR5这一艾滋病感染的重要途径来预防感染。而Amarex Clinical Research作为CRO则为该公司负责临床开发。
令人异常疑惑的是,在收购完成后,作为科学家的Richard G. Pestell担任了CytoDyn的首席医疗官,但是在2019时,该公司竟然无故解雇了Richard G. Pestell,双方直到2022年才达成非现金和解。

图:Richard G. Pestell
这一疑惑行为似乎为后来的种种事件埋下了不详的伏笔。
在2020年新冠大流行时期,CytoDyn方面曾经将leronlimab用于开发新冠病毒,这也很好理解。这个时期,大量的药企在新冠病毒药物开发中投入精力,一方面有补贴,另外一方面新冠药物市场潜力巨大,对于投资者来说也算是好消息。
但问题就在于,leronlimab以新冠适应症提交的BLA其实并不合格,数据仍不完整,当时CytoDyn的CEO Pourhassan找上了Amarex Clinical Research的联合创始人、总裁兼首席执行官Kazempour,同时也是CytoDyn披露委员会的成员,该委员会负责审查和批准该生物技术向美国证券交易委员会(SEC)提交的文件。
Pourhassan告诉Kazempour和Amarex,会向FDA提交一份不完整的BLA,即便FDA不会去过目这种不完整的BLA,之后还会发拒绝函,但是这可以给投资人有个交代。
提交BLA对于股价来说绝对是个利好消息,因此这里(如下图所示)也可以明显看到CytoDyn的股价在那个时间段出现了大涨。
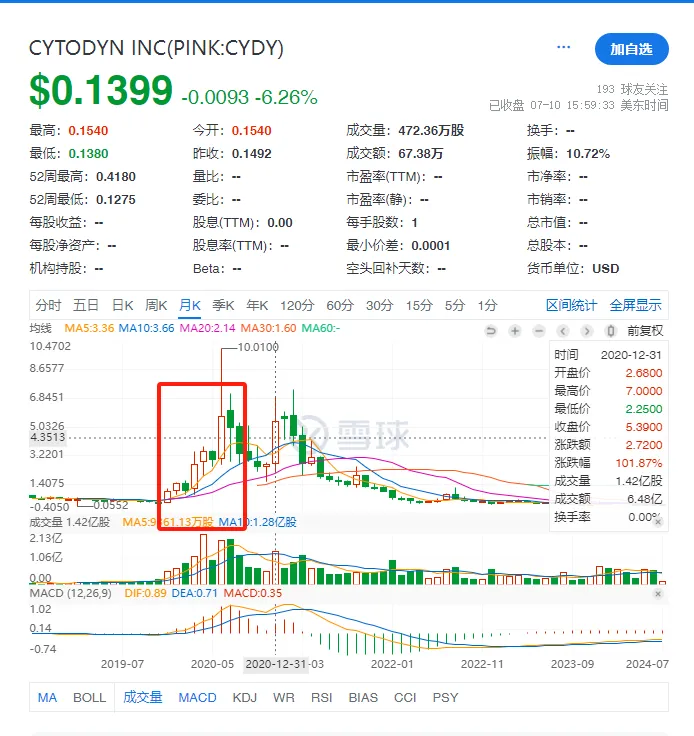
而在2016年到2020年之间,CytoDyn的股价倒是一直处于1美元之下,开发新冠适应症确实是这家企业逆天改命的机会。
当然,Pourhassan和Kazempour也很清楚地知道BLA本身并不完整,是一定会被FDA拒绝的。不过,至少自身的利益需要保障,因此在这种情况下,Kazempour开始出售超过420,000美元的CytoDyn股票。
有趣的是,FDA在收到BLA后,几天内就提醒了该公司这些不足之处,但Pourhassan偏偏也没把这事情告诉股东们,根据后续法庭的说法,Pourhassan通过虚假信息出售价值1580万美元的生物技术股票,获利超过470万美元。
而后这项骗局就随着谎言的编织越变越大。
虽然BLA有问题,但总归是在这个背景下提交了,当然也在2021年不出意外的失败了。
投资者vs FDA
临床失利之后,通过寻求分析亚组数据来获得批准是一些药企经常可能尝试的行为,CytoDyn也打算这样做,并仍然声称leronlimab对于新冠有效。
该公司将数据发布集中在一个由62名机械通气的重症新冠肺炎患者组成的亚组,声称该药物促使全因死亡率降低了24%,住院时间减少了6天。后来,CytoDyn还进行了“年龄调整”分析,声称显示leronlimab降低了老年患者的死亡率。
但显然FDA并不同意CytoDyn的观点。FDA在公开声明中谴责了CytoDyn的做法:“很明显,目前可用的数据不支持leronlimab治疗新冠肺炎的临床益处,使用已建立分析方法来校正多重比较时,这些分析都不符合统计学意义。”
这种声明上的冲突引起了CytoDyn投资人与FDA的冲突。CytoDyn投资人是一个专门的团体,他们聚集在推特上,只要稍微提到治疗的问题就会为leronlimab辩护。
他们疯狂指责是FDA的过错。
一组投资者甚至提出了自己的解决方案,让leronlimab去达到癌症的临床终点(当时还有开发癌症适应症)。
在后续的电话会议上,Pourhassen极力为FDA辩护,表示:“你可以向我扔各种各样的鸡蛋和西红柿,无论你喜欢什么。这是我应得的。但请不要对监管机构那样做。”
“FDA没有做错任何事,我们做错了。”
在Pourhassen的发言中,至少11次提到了他对FDA“心存感激”,因为leronlimab以前是一种被搁置的药物,现在被用于新冠肺炎试验。
这种自相矛盾的发言最终导致CytoDyn放弃了leronlimab在新冠适应症上的开发。
Pourhassan的谎言也再无法持久,东窗事发后Pourhassan最终被解雇,被美国法院指控欺诈(将于2024年11月宣判)。
HIV搁置风波
但整件事并没有完结,前文提到leronlimab本身就是一款被FDA暂停了在HIV开发的药物,2022年3月时,Leronlimab遭到了临床搁置。
当时CytoDyn并没有披露关于这场临床搁置的具体信息,但随后这家公司又把锅甩给了之前一起合谋欺诈消费者的CRO Amarex。
其实想来其实也是合理的,既然提交新冠适应症的时候都是数据不全,甚至有许多差错的,那么在HIV开发过程中,可能也同样如此。
在2020年7月时,该公司试图递交Leronlimab关于HIV的NDA,但是同样缺乏数据,因此遭到了FDA的拒绝。
虽然其后再度提交了CMC让临床得以继续进行,但2022年3月的搁置给这一药物的开发致命一击,同年10月放弃开发。
这最终导致了原本的合作方对簿公堂,实际也可能是CytoDyn的现有资金(目前该公司账上现金及其等价物约为1千万美元)完全不足够支付Amarex的应收账款。
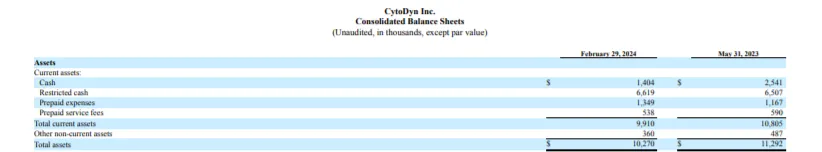
CytoDyn指责Amarex在数据质量方面存在“系统性问题”。CytoDyn指出,这些问题是2022年10月撤回leronlimab在特定HIV适应症中的批准申请的原因。
现在,在官司成功后,该公司账上估计有2千万美元的现金,而CytoDyn这家公司仍然没有放弃Leronlimab,还打算开发非酒精性脂肪肝和脑癌的适应症。
他们会成功吗?或许拭目以待。

总结
总的来看,CytoDyn和Amarex一系列争端或许从最开始的谎言和欺诈中就埋下了,本可以避免,但两家公司的CEO却放弃了这样的机会。愿做创新药多一点真诚。

 产业资讯
产业资讯
 E药经理人
E药经理人  2025-07-16
2025-07-16
 46
46

 产业资讯
产业资讯
 识林
识林  2025-07-16
2025-07-16
 43
43

 产业资讯
产业资讯
 胖猫的生命科学札记
胖猫的生命科学札记  2025-07-16
2025-07-16
 44
44