 产业资讯
产业资讯
 细胞治疗前沿
细胞治疗前沿  2024-08-02
2024-08-02
 1462
1462
当地时间7月31日,Umoja Biopharma宣布美国FDA已批准其在研CD19靶向原位生成(in-situ generated)CAR-T细胞疗法UB-VV111的IND申请,用以治疗血液恶性肿瘤。Umoja预计将在2024年底前启动1期试验并进行首位患者给药。根据新闻稿,UB-VV111可能是血液学人体试验中首个原位生成CD19靶向CAR-T细胞疗法。
Umoja基于其专有的第三代慢病毒载体技术,制造了VivoVec基因递送产品。VivoVec引入身体后,患者能够制造自己的抗癌CAR-T细胞。这些细胞通过RACR / CAR系统进行基因重组,使临床医生能够控制其功能。
这种现成的技术避免了体外细胞治疗的复杂性和延迟性,降低了治疗费用,同时在更适合传统CAR-T体外疗法的环境中提供体外适用性。
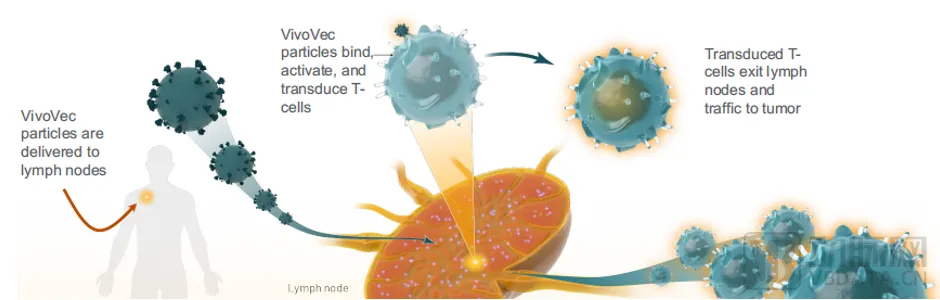
▲ VivoVec平台运作过程,图源Umoja
UB-VV111是一款通过VivoVec平台开发的体内CAR-T细胞疗法。UB-VV111包含一个表面经过工程化的病毒包膜,以及编码CD19靶向CAR和雷帕霉素激活细胞因子受体(RACRTM)的转基因,旨在于患者体内扩增UB-VV111工程化CAR-T细胞。该疗法是VivoVec基因递送平台进入临床的首个管线。
UB-VV111的1期研究是一项剂量递增和验证研究,旨在评估UB-VV111的安全性、耐受性和临床抗肿瘤活性。该研究将招募复发/难治性大B细胞淋巴瘤(LBCL)和慢性淋巴细胞白血病(CLL)患者,包括CAR-T初治患者和经治患者。
2024年1月,Umoja和艾伯维(AbbVie)达成两项总额潜在超过14亿美元的独家选择权和许可协议,利用Umoja专有的VivoVec平台,在肿瘤学领域(以及潜在免疫学领域)开发多种原位生成的CAR-T细胞疗法候选药物。
目前有许多医药公司正在进行体内细胞疗法的开发,包括Moderna、Capstan Therapeutics、Myeloid Therapeutics和Interius BioTherapeutics,其中Interius本月初已获得在澳大利亚启动人体试验的批准。

 产业资讯
产业资讯
 E药经理人
E药经理人  2025-07-16
2025-07-16
 43
43

 产业资讯
产业资讯
 识林
识林  2025-07-16
2025-07-16
 41
41

 产业资讯
产业资讯
 胖猫的生命科学札记
胖猫的生命科学札记  2025-07-16
2025-07-16
 42
42