 研发追踪
研发追踪
 生物药大时代
生物药大时代  2024-08-12
2024-08-12
 1901
1901
在被FDA拒绝一年后,Citius Pharmaceuticals赢得了美国监管机构的青睐,获得了Lymphir(denileukin diftitox-cxdl)的批准,用于治疗复发或难治性皮肤T细胞淋巴瘤(CTCL),这些患者至少尝试过一种全身疗法。
Lymphir成为该适应症中第一个特异性靶向在恶性T细胞和调节性T细胞(Tregs)上发现的白细胞介素-2(IL-2)受体的治疗方法。这也是这家拥有17年历史的新泽西公司的第一个FDA批准的产品,该公司预计将在未来五个月内推出Lymphir。
Lymphir是卫材CTCL治疗Ontak的改进版本,该疗法于1999年至2014年上市。这家日本公司于2014年撤回了该产品,原因是与其细菌表达相关的制造问题。
在开发出更纯化的Ontak配方以解决这些生产短缺问题后,卫材将其在亚洲以外的权利出售给了Reddy博士实验室。然后在2021年,这家印度公司以4000万美元的预付款将 Lymphir 转售给 Citius,另外 4000 万美元将在 FDA 批准后到期。
去年夏天,Citius似乎处于FDA点头的边缘,然后该机构向该公司发送了一封完整的回复信(CRL),要求加强产品测试和“额外控制”,这是该机构此前在审查期间提出的要求。CRL中没有发现疗效或安全性问题。
Citius首席执行官Leonard Mazur在一份新闻稿中表示:“Lymphir的推出具有迅速减少皮肤病和控制症状性瘙痒而无累积毒性的潜力,预计将扩大CTCL治疗领域并增长整体市场,目前估计为3亿至4亿美元。
Citius没有透露Lymphir的价格。该公司在一封电子邮件中表示,该价格“预计将与CTCL的其他全身疗法保持一致”。
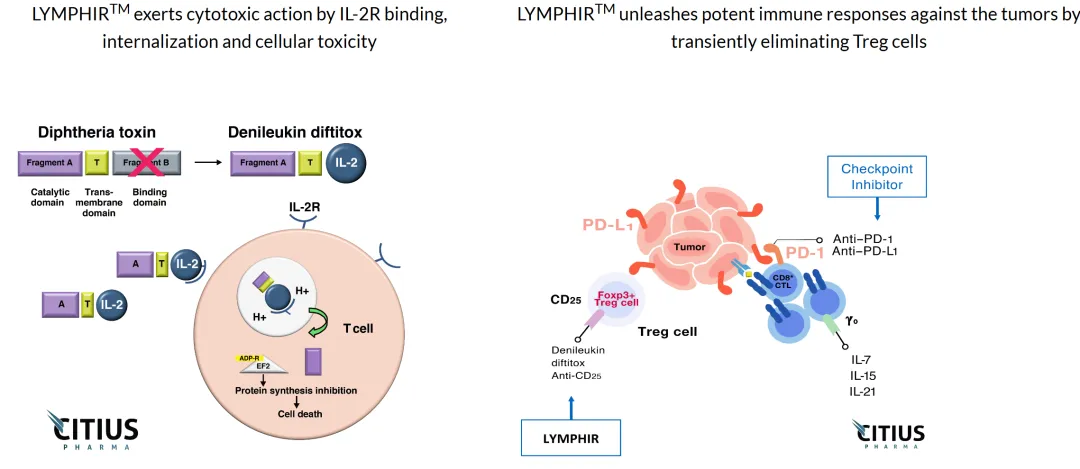
Lymphir的作用机制(图片来源:Citius官网)
关于Citius Pharma
Citius Pharmaceuticals, Inc.(纳斯达克股票代码:CTXR)是一家处于早期阶段的生物制药公司,专注于一流重症监护产品的开发和商业化,在癌症辅助治疗、肿瘤学、干细胞疗法和独特处方产品方面拥有一系列抗感染药物。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 20
20

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 20
20

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 18
18