 产业资讯
产业资讯
 医药魔方
医药魔方  2024-08-29
2024-08-29
 2512
2512
以PD-(L)1免疫检查点抑制剂、靶向疗法为代表的抗肿瘤新药开辟了肿瘤治疗新天地,而抗体药物偶联药(ADC)这种新型药物形式的出现使肿瘤治疗迈向了新的台阶。在制药巨头的带动下,ADC新药开发如火如荼,角逐异常激烈,同时带来了很多突破,包括在HER2之外有更多创新靶点以ADC形式成药,为肿瘤临床治疗带来变革。
安斯泰来开发的Padcev(注射用维恩妥尤单抗)就是一款first in class的靶向Nectin-4的ADC新药,以突破性疗法的身份最早在2019年12月18日获得FDA加速批准上市,从递交上市申请到获批仅用了2个月时间。不仅获批速度惊人,Padcev上市后的销售成绩也格外亮眼,2023年全球销售额已达11.18亿美元,进入“10亿美元分子俱乐部”,也是目前为数不多年销售额破10亿美元的ADC药物之一。
2024年8月19日,注射用维恩妥尤单抗也获得了国家药品监督管理局批准上市, 用于既往接受过含铂化疗和PD-(L)1抑制剂治疗的局部晚期或转移性尿路上皮癌(la/mUC)成人患者。这款全球首创的Nectin-4 ADC新药首次成功登陆中国,意味着中国晚期尿路上皮癌患者也将能够从这一全新的治疗选择中实现获益。
全球首创——中国晚期尿路上皮癌患者迎来全球最新疗法
尿路上皮癌(UC)是最常见的膀胱癌类型。据报告,全球膀胱癌每年新发病例约57.3万例,死亡21.2万例,其中约90%患者为UC病例,转移性UC患者的5年生存率不足9%。2022年国家癌症中心发布报告显示,在我国,膀胱癌年发病率约为8.2/10万,死亡率高达3.4/10万,也就意味着中国每年有超过47600例膀胱癌患者死亡。
在过去,化疗一直是无法手术的la/mUC患者的标准疗法。2016年之后, PD-(L)1抑制剂将膀胱癌治疗推进至免疫治疗时代。不过对于既往接受过PD-(L)1抑制剂和含铂化疗后疾病进展的患者,治疗选择仍十分有限。ADC在实体瘤的成功也让科学家将目光瞄准UC这一临床需求远未满足的领域。Nectin-4 ADC、HER2 ADC、TROP2 ADC等均在这一肿瘤细分赛道进行了探索。最终,安斯泰来开发的维恩妥尤单抗率先实现突围,成为了全球首款获批治疗晚期UC的ADC新药。
“Nectin”来源于拉丁语necto,意为“连接”。Nectin-4(基因名为PVRL4,脊髓灰质炎病毒受体4)是一种不依赖Ca2+的类免疫球蛋白,与其他Nectin蛋白(Nectin-1,-2和-3)一起主要参与细胞间的粘附,对于实现细胞间通讯、迁移和其他重要细胞过程至关重要。
相较于其他Nectin,Nectin-4广泛存在于实体瘤中,在尿路上皮癌,乳腺癌,肺癌,头颈癌,卵巢癌等肿瘤中均具有极高的表达,而在正常组织中表达较低。研究发现,Nectin-4可通过激活P13K/Akt通路促进肿瘤的增殖和迁移,是一种肿瘤相关诱导剂。这些特性使Nectin-4成为了一种理想的抗肿瘤药物靶点。
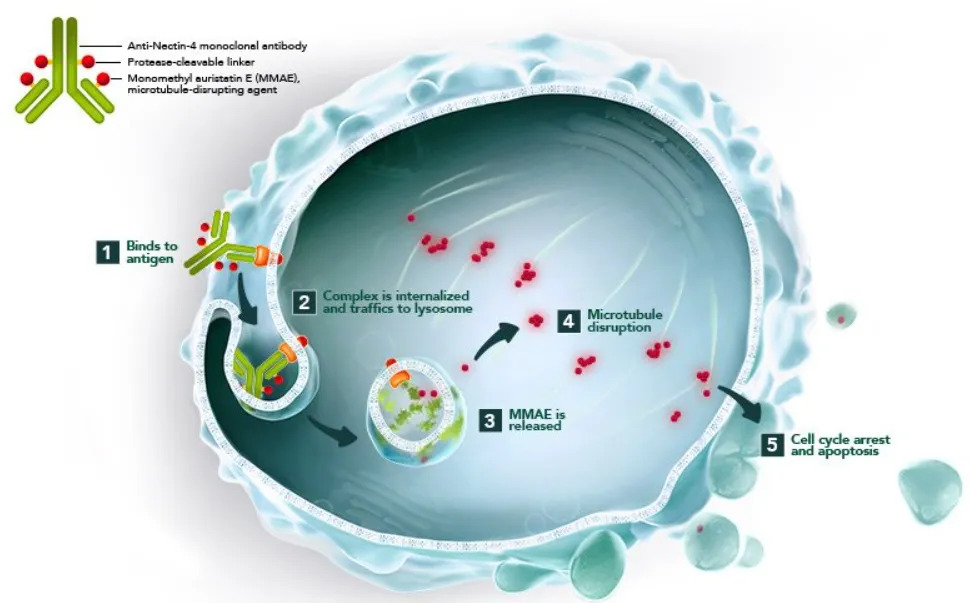
来源:Seagen官网
维恩妥尤单抗是由靶向Nectin-4的人IgG1单克隆抗体enfortumab与细胞毒制剂MMAE(单甲基奥瑞他汀E,一种微管破坏剂)偶联而成。通过与表达Nectin-4蛋白的细胞结合,然后将MMAE内化并释放到细胞中,导致细胞停止增殖(细胞周期阻滞)和程序性细胞死亡(凋亡)。
维恩妥尤单抗的抗癌效果在临床研究中得到证实。此次在中国获批正是基于全球EV-301研究和中国EV-203研究积极结果,维恩妥尤单抗显著改善了既往接受过含铂化疗和PD-(L)1抑制剂治疗患者的总生存期(OS)和客观缓解率(ORR)。
EV-301研究结果显示,维恩妥尤单抗组的中位OS比化疗组更长(12.88 vs 8.97个月;HR:0.70;95% CI:0.56-0.89;p=0.001),PFS也长于化疗组(5.55 vs 3.71个月;HR:0.62;95% CI:0.51-0.75;P<0.001)。 两组治疗相关的不良事件发生率相似(93.9% vs 91.8%)。3级及以上不良事件的发生率也相似(51.4% vs 49.8%)。
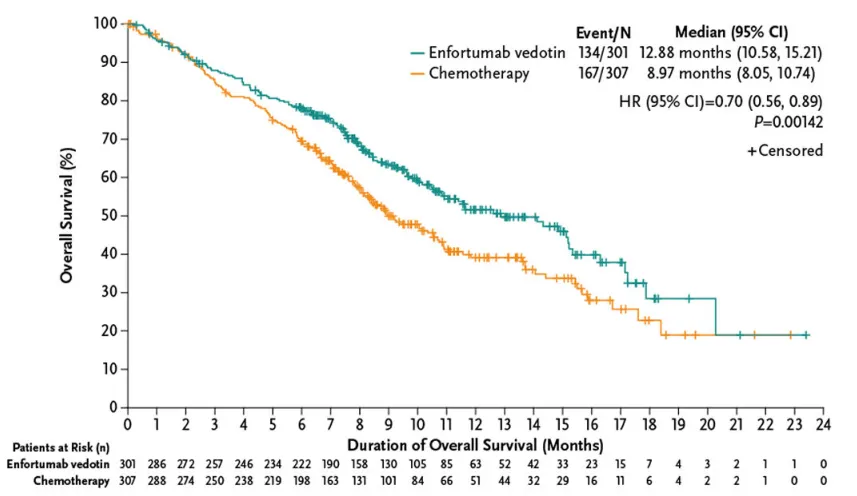
来源:N Engl J Med. 2021;384(12):1125-1135.
FDA曾基于单臂II期EV-201研究队列1的数据加速批准维恩妥尤单抗治疗既往接受过PD-(L)1抑制剂和含铂化疗治疗的la/mUC患者,125例受试者的ORR为44%,中位PFS为5.8个月,中位OS为11.7个月;此后又基于III期EV-301研究和EV-201研究队列2试验结果,将这一批准转为常规批准,同时还批准其用于治疗不适合接受顺铂化疗,且既往接受过一种或多种治疗的la/mUC患者。由此可见,维恩妥尤单抗二线治疗晚期UC患者的疗效经住了多项研究的考验,证实了其对这类患者的临床获益。维恩妥尤单抗二线治疗la/mUC患者疗效数据
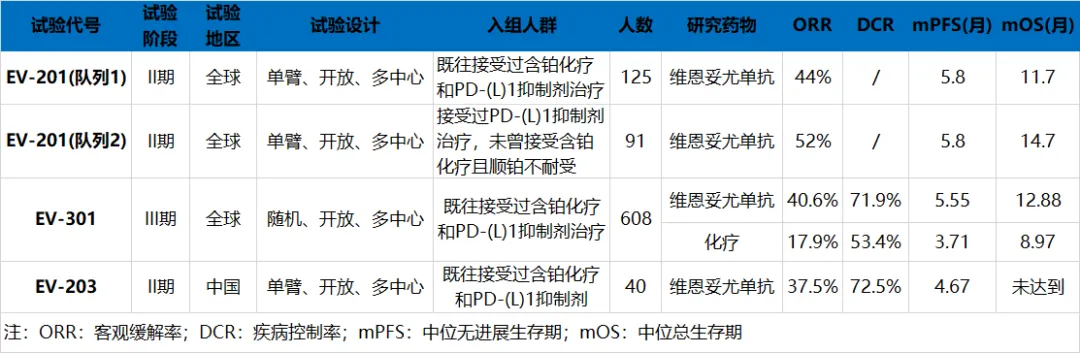
来源:医药魔方数据库
事实上,继维恩妥尤单抗之后,靶向TROP 2的ADC药物戈沙妥珠单抗也基于II期、单臂TROPHY研究获FDA加速批准用于治疗既往接受过PD-(L)1抑制剂的局部晚期或转移性mUC患者,遗憾的是,该款药物的确证性III期TROPiCS-04研究未达到OS主要终点,FDA是否会撤回该项适应症也未可知。此外,维迪西妥单抗虽在中国附条件批准用于治疗既往接受过含铂化疗的局部晚期或转移性尿路上皮癌患者,不过仅限于HER2过表达(HER2 免疫组织化学检查结果为2+ 或3+)患者,这也意味着患者是否能接受该款药物治疗需要提前进行靶点检测;开发进度更晚一些的9MW2821正在中国开展治疗la/mUC 的III期研究。由此可见,无论是在疗效方面,还是在覆盖人群,临床运用便利性,以及当前患者可及性方面,维恩妥尤单抗均有其独特优势,在全球以及中国尿路上皮癌这一细分领域的领先地位较为明显。
ADC+IO联合疗法正成为肿瘤治疗新范式,维恩妥尤单抗+PD-1打头阵
ADC单药使用已被证明具有强大的抗肿瘤效果,并在多种实体瘤和血液瘤中获得了批准。不过,更长时间的肿瘤缓解和临床治愈需求促使研究人员探索更多元的临床治疗策略。ADC联合化疗、靶向疗法、以及肿瘤免疫(IO)治疗策略有望在现有疗法基础上进一步提高患者生存率和生存时间,这些治疗模式正在成为肿瘤临床治疗新的范式。ADC+IO治疗无疑是目前研发热度最高的联合治疗方案,此前,多个癌种的临床试验数据显示PD-(L)1等免疫疗法联用ADC展现出优异的疗效,而这一类方案也被众多布局ADC的医药创新企业视为肿瘤免疫新一轮竞争“超车”的机会。根据医药魔方TrialCube数据库,目前全球已经开展/完成的用于治疗实体瘤的ADC联合IO治疗的关键注册性III期临床研究多达24项。其中包括第一三共的德曲妥珠单抗联合TIGIT单抗rilvegostomig治疗HER2+胆道癌的III期研究;默沙东/科伦博泰、第一三共的TROP2 ADC分别联合PD-1抑制剂治疗非小细胞肺癌、三阴性乳腺癌;以及国内企业恒瑞医药、荣昌生物等各自的ADC新药联合PD-(L)1制剂治疗多种实体瘤研究等。全球已开展/完成的ADC+IO治疗实体瘤关键注册性III期研究
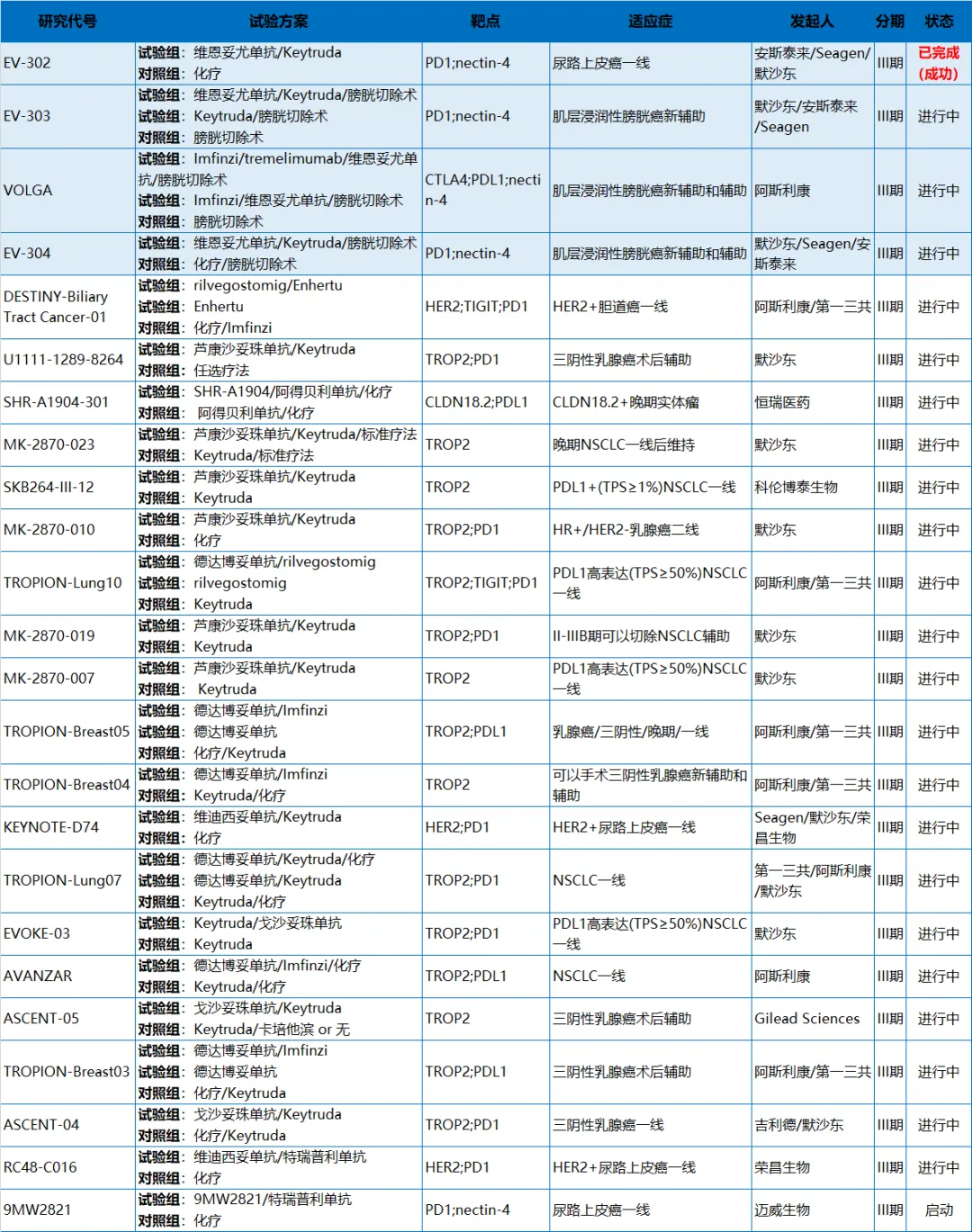
来源:医药魔方TrialCube数据库
从上表我们也可以看到,除了EV-302研究外,其他ADC+IO联合治疗的关键性III期研究均在进行中。也就是说,维恩妥尤单抗联合帕博利珠单抗(Keytruda)一线治疗尿路上皮癌的III期EV-302研究是目前唯一一个试验成功的注册性III期研究,并成功获得监管机构认可、成功运用于临床的治疗方案。2023年4月3日,基于Ib/II期EV-103研究列A和队列K结果,维恩妥尤单抗联合帕博利珠单抗获FDA加速批准,用于一线治疗不适合接受以顺铂为基础化疗的la/mUC患者,开创了ADC+IO联合治疗的先河。EV-103研究中,在剂量递增/队列A和队列K(n=121)的合并疗效分析中,联合疗法的ORR为68%,CR和PR率分别达到12%和55%。2023年12月15日,基于EV-302研究积极结果,FDA将这一联合治疗方案转为常规批准,用于一线治疗la/mUC,并且不再限制患者是否耐受含铂化疗。FDA相较PDUFA预定日期提前了近5个月批准该申请。这是首个也是唯一一个获批治疗膀胱癌的PD-1+ADC组合疗法。EV-302研究中,共有886例既往未接受过治疗的la/mUC且能耐受含铂化疗的患者被纳入,结果显示,与含铂化疗方案相比,接受维恩妥尤单抗与帕博利珠单抗联合疗法患者的OS和PFS均出现统计学显著性改善。维恩妥尤单抗联合疗法组患者的中位OS为31.5个月(95% CI:25.4-未达到),而化疗组为16.1个月(95% CI:13.9-18.3),即与化疗组相比,联合疗法组患者的死亡风险降低了53%(HR:0.47,95% CI:0.38-0.58,p<0.0001)。
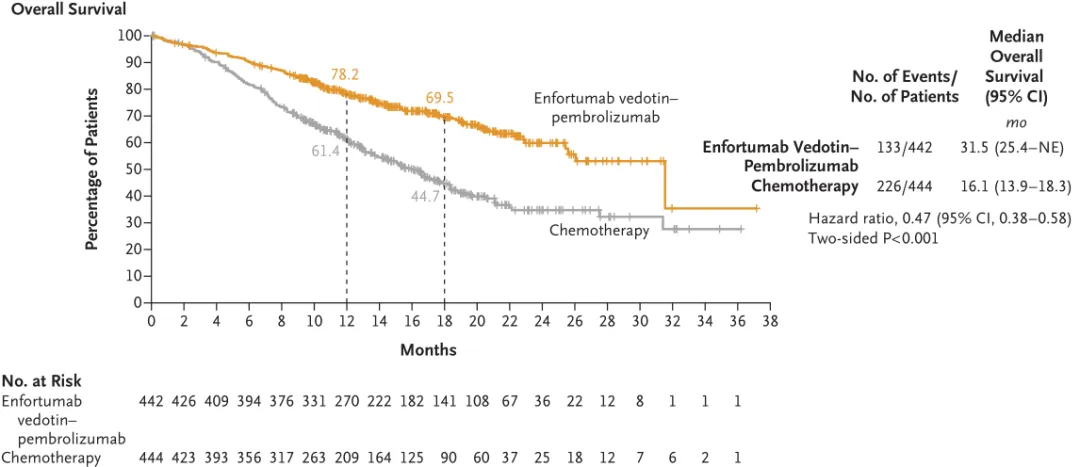
来源:N Engl J Med. 2024;390(10):875-888.
此外,接受维恩妥尤单抗联合疗法患者的中位PFS为12.5个月(95% CI:10.4-16.6),而化疗组为6.3个月(95% CI:6.2-6.5),即与化疗相比,联合疗法组患者疾病进展或死亡风险降低了55%(HR:0.45,95% CI:0.38-0.54,p<0.0001)。EV-302研究的试验数据在2024年最新版的NCCN/ESMO/EAU指南都进行了更新,维恩妥尤单抗联合帕博利珠单抗被推荐作为晚期一线la/mUC的治疗首选。

来源:NCCN临床指南:膀胱癌(Version 4.2024)
除此之外,维恩妥尤单抗联合Imfinzi(度伐利尤单抗)、tremelimumab(CTLA4单抗)以及维恩妥尤单抗联合帕博利珠单抗用于肌层浸润性膀胱癌新辅助和辅助治疗的III期注册性研究(VOLGA和EV-304)正在进行中,临床结果值得期待。治疗前移意味着更广泛的人群覆盖,广阔的市场空间和商业前景。随着多项临床研究的启动和更多疗效数据的出炉,维恩妥尤单抗在早期膀胱癌患者中的治疗潜质将得到进一步的印证,商业价值也将进一步得到提升。总结维恩妥尤单抗作为全球首款成功获批上市的Nectin-4 ADC新药,其单药治疗的疗效不仅在多项临床研究中得到了验证,为晚期尿路上皮癌患者二线以上治疗带来了全新的治疗选择。同时其也开创了ADC联合肿瘤免疫治疗的先河,为癌症患者开拓了一条全新的治疗路径,也使更多的ADC新药朝着联合肿瘤免疫治疗的方案迈进,进而为患者争取更优的治疗选择。此次维恩妥尤单抗在中国的获批是其又一个里程碑,将会惠及更多的中国晚期尿路上皮癌患者。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 124
124

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 115
115

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 102
102