 研发追踪
研发追踪
 医麦客
医麦客  2024-09-23
2024-09-23
 1444
1444
当地时间9月17日,Atsena Therapeutics 宣布其在研AAV基因疗法ATSN-201 获FDA授予孤儿药资格认定,用于治疗 X 连锁视网膜劈裂症(XLRS)。这是ATSN-201继上个月获罕见儿科认定后的第二次FDA认定。
ATSN-201 是一种潜在“best-in-class”基因疗法,利用Atsena公司的新型扩散衣壳AAV.SPR在中央视网膜的光感受器中达到治疗所需的基因表达水平,同时避免视网膜中央窝脱离的手术风险。
XLRS 是一种由编码视网膜劈裂蛋白的 RS1 基因突变引起的单基因 X 连锁疾病。其特征是视网膜层间的异常分裂,导致无法通过眼镜矫正的视力减退,并逐渐导致视力丧失,最终致盲。XLRS主要影响男性,通常在儿童早期被诊断。在美国和欧盟,大约有30,000名男性患有XLRS,但目前还没有获批上市的治疗方法。
ATSN-201是一种腺相关病毒(AAV)基因疗法,利用该公司的一种新型传播衣壳技术AAV.SPR来克服玻璃体内递送的AAV在治疗XLRS中的相关挑战。当注射到黄斑外区域时,它会横向扩散到视网膜下注射部位之外,从而能够安全有效地传导中央视网膜(XLRS患者视网膜中主要是裂腔)。
FDA 罕见儿科疾病认定,主要用于治疗18 岁以下的严重或危及生命的罕见病患者。该认定ATSN-201 将使该疗法在获得批准后获得优先审评券 (PRV),极大地激励了 Atsena 这类公司投资于罕见的儿科疾病。
而这次ATSN-201的孤儿药资格认定旨在为美国不到 200,000 人的罕见病患者提供一种安全有效的治疗、诊断或预防疗法。同时,提供了一定的激励措施,如获得批准后临床试验费用的税收抵免和处方药使用者费用减免。对处于获批FDA孤儿药状态的产品,其拥有七年孤儿药认定疾病所在市场的独占权,该权利不受知识产权保护。
目前,ATSN-201的 I/II 期临床试验正在进行中,旨在评估该疗法的安全性和耐受性。该试验为一项开放标签、剂量递增和剂量扩展的临床试验(LIGHTHOUSE研究),研究对象为 6 岁及以上临床诊断为 RS1 基因突变引起的 XLRS 的男性患者。
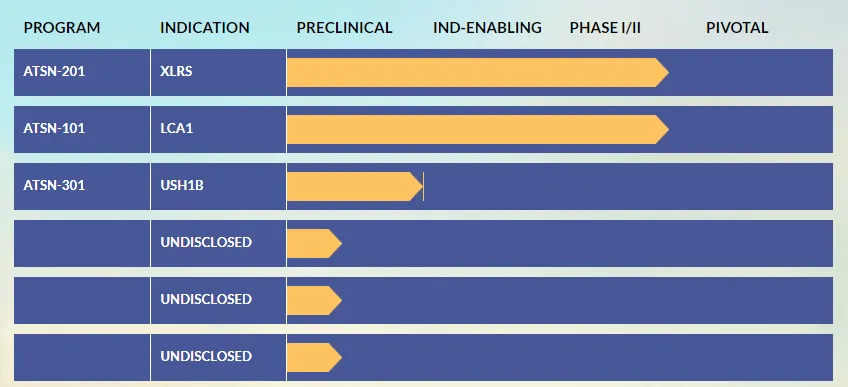
▲ Atsena Therapeutics管线图(源自官网)
Atsena Therapeutics 是一家临床阶段的基因治疗公司,致力于开发best-in-class疗法用于逆转或预防遗传性视网膜疾病。该公司的主导项目正在对ATSN-201进行一项I/II期临床试验,用于治疗XLRS,这是一种通常在儿童时期被诊断出的、影响男孩和男性的渐进性遗传病症。另一项正在进行的I/II期临床试验旨在评估ATSN-101对GUCY2D (LCA1) 双等位基因突变引起的 leber 先天性黑朦患者的疗效。该疗法已获得获得FDA罕见儿科疾病认定、再生医学先进疗法 (RMAT) 认定和孤儿药资格认定。另外,ATSN-301是一种基于双 AAV 载体的基因疗法,仍处于临床前的研究,用以预防 MYO7A 相关 Usher 综合征 (USH1B) 致盲。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 17
17

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 17
17

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 14
14