 研发追踪
研发追踪
 医药魔方Info
医药魔方Info  2024-10-21
2024-10-21
 1314
1314
10月16日,GSK宣布美国FDA已受理Gepotidacin的新药上市申请(NDA)并授予其优先审评资格,用于治疗单纯性尿路感染(uUTI)的女性成人患者(≥40kg)和青少年患者(≥12岁,≥40kg),PDUFA日期为2025年3月26日。

Gepotidacin是一种在研的靶向拓扑异构酶II(Top II)的first in class新型口服抗生素,其结构属于三氮杂苊烯类,不同于现有的喹诺酮类抗生素。相比于喹诺酮类抗生素(单一抑制Top II或Top IV),Gepotidacin具有全新的作用机制,可选择性且均衡抑制细菌DNA回旋酶(Top II的一种)和Top IV,从而抑制细菌DNA复制。由于Gepotidacin对Top II和Top IV为均衡抑制,因此,当这两种酶均发生突变时才会显著影响细菌对Gepotidacin的敏感性。
Gepotidacin结构
此次申请得到了两项关键性III期研究的阳性数据支持,即EAGLE-2和EAGLE-3研究。EAGLE-2和EAGLE-3研究均为全球性、随机、双盲、非劣效性(界限值为10%)III期临床研究,共纳入了3136例患者,旨在评估Gepotidacin(1500mg,每日2次)对比呋喃妥因(100mg,每日2次)治疗uUTI的有效性和安全性。研究的主要终点为第10~13天治愈检验期(TOC)访视时产生治疗应答(包括临床应答和微生物学应答)的患者数量。在EAGLE-2研究中,Gepotidacin组有50.6%的患者实现“治疗成功”,呋喃妥因组为47.0%。在EAGLE-3研究中,Gepotidacin组有58.5%的患者实现“治疗成功”,呋喃妥因组为43.6%。此外,在治疗失败风险更高的关键亚组中,Gepotidacin也表现出一致的非劣效于呋喃妥因的疗效,包括大肠杆菌病原体对其他抗生素耐药的患者、有复发史的患者和50岁以上的患者。
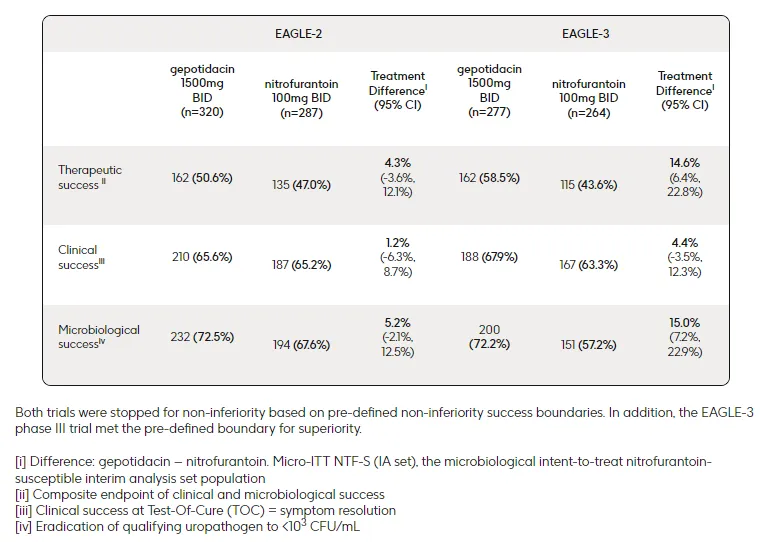
EAGLE-2和EAGLE-3研究主要结果(来源:GSK官网)
Gepotidacin组最常报告的不良事件(AE)是胃肠道反应,其中腹泻(16%)和恶心(9%)较为常见。不过这些AE的严重程度大多数为轻度(1级,69%)和中度(2级,28%)。非复杂性尿路感染 (uUTI) 是最常见的门诊感染,超过一半的女性在其一生中会患上uUTI,超过四分之一的女性患有复发性uUTI。Gepotidacin一旦获批,将成为20多年来首个治疗uUTI 的新型口服抗生素。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 12
12

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 12
12

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 10
10