 研发追踪
研发追踪
 UmabsDB
UmabsDB  2025-07-07
2025-07-07
 1490
1490
Umabs DB作为目前全球最全面的抗体药物专业数据库,收录全球近10000个从临床前到商业化阶段抗体药物,涉及靶点1600+,涉及疾病种类2400+,研发机构2900+,覆盖药物蛋白序列、专利和临床等多种专业信息。Umabs DB药物数据库已正式开放上线,可访问www.umabs.com注册享受7天免费试用。
2025年6月30日,安进宣布在胃癌一线治疗中评估FGFR2b抗体Bemarituzumab,联合化疗 (mFOLFOX6) 的 3 期 FORTITUDE-101 临床试验在预先指定的中期分析中达到了总生存期 (OS)的主要终点,试验的详细结果将在未来的医学会议上分享。

FORTITUDE-101 是一项随机、多中心、双盲、安慰剂对照的 3 期临床研究,旨在比较 bemarituzumab 联合 mFOLFOX6
与安慰剂联合 mFOLFOX6 作为一线治疗方案治疗 FGFR2b 过表达的晚期胃食管结合部 (G/GEJ) 癌。FORTITUDE-101 试验在 37
个国家/地区的 300 个研究中心开展,共入组 547 名患者。该试验的主要临床终点指标是FGFR2b≥10% 2+/3+肿瘤细胞染色患者的总生存期。
对于FGFR2b过表达且非HER2阳性的不可切除局部晚期或转移性胃癌或胃食管连接部(G/GEJ)癌患者,与安慰剂联合化疗相比, bemarituzumab 联合化疗显示出统计学上显著且具有临床意义的OS改善。FGFR2b过表达定义为通过集中进行的免疫组织化学(IHC)检测,≥10%的肿瘤细胞染色为2+/3+。
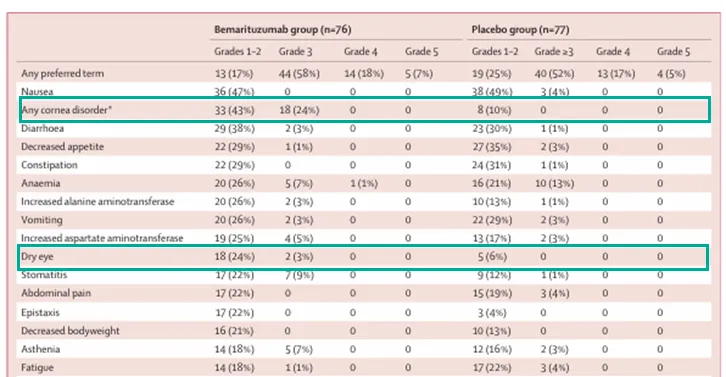
在接受 bemarituzumab 联合化疗治疗的患者中,最常见的治疗中出现的不良事件(>25%)包括视力下降、点状角膜炎、贫血、中性粒细胞减少、恶心、角膜上皮缺损和干眼症。虽然眼部事件与 2 期试验结果一致,且在两组中均有观察到,但在 3 期 bemarituzumab 组中,这些事件的发生频率和严重程度更高。
胃癌是全球第五大高发癌症,每年全球新发病例近一百万,而中国是全球胃癌疾病负担最重的国家之一,据估计每年新发病例约35.87万例,死亡病例达26.04万例。在中国,约80%的胃癌患者在确诊时已处于晚期或转移阶段。对于IV期胃癌患者,其总体五年生存率不足10%。

FGFR2b蛋白(也称为成纤维细胞生长因子受体2
IIIb亚型)是一种新兴的生物标志物。当其过表达时,会促进信号通路异常激活,从而导致肿瘤细胞增殖。
在晚期胃癌或胃食管结合部(G/GEJ)癌患者中,约有38%的患者其G/GEJ肿瘤细胞存在FGFR2b蛋白过表达。FGFR2b蛋白过表达定义为通过免疫组织化学(IHC)检测显示肿瘤细胞膜染色强度为2+/3+。约16%晚期G/GEJ癌患者中,通过IHC检测观察到≥10%的肿瘤细胞存在FGFR2b蛋白过表达。
Bemarituzumab为安进和再鼎合作开发的FGFR2b抗体,对于配基FGF7/FGF10均具有强阻断功能,采用potelligent专利技术进行表达生产,去岩藻糖比例提高至90%以上,显著提高ADCC效应。
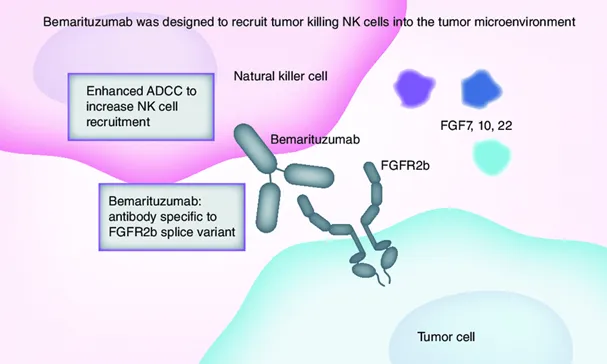
二期临床结果中,Bemarituzumab联合化疗疾病进展风险和死亡风险分别减少了32%和42%,对于10%以上肿瘤细胞过表达FGFR2b的患者,疾病进展和生存获益进一步放大。但基于FGF10配基的强阻断,二期临床中角膜疾病和干眼症发生率高达67%和27%,对照组仅为10%和6%。
FORTITUDE-101试验由再鼎医药支持开展。再鼎医药拥有贝马利珠单抗在中国大陆的联合开发和商业化权利。中国,香港,澳门,
和台湾。同时针对一线胃癌患者,贝马利珠单抗联合化疗和纳武单抗的 3 期研究也正在进行中,预计数据将于 2025 年下半年公布。
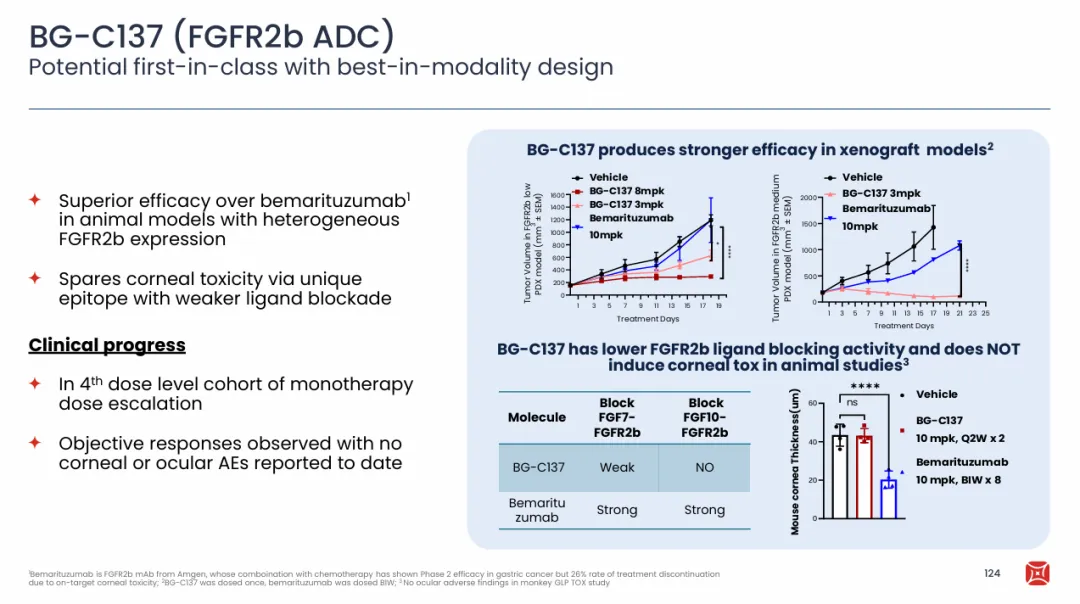
此前虽然包括拜耳也采用了传统技术尝试FGFR2b ADC疗法,但随着Bemarituzumab在胃癌治疗中的确定性增加,包括百济神州、华东医药和先声医药等多家公司开发了FGFR2b的下一代ADC药物,一方面基于抗体表位的优化,避免了FGF10的阻断带来的眼部毒性,同时在ADC的构造方面采用了下一代的技术平台以提高治疗窗口。
更多有关抗体药物具体信息、专利及临床等动态进展,敬请关注Umabs DB全球数据库(www.umabs.com)的更新。
英文链接:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 50
50

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 44
44

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 42
42