 产业资讯
产业资讯
 药融圈
药融圈  2024-10-29
2024-10-29
 1353
1353
根据世界卫生组织下属的国际癌症研究机构统计,肺癌正重新成为全球第一大癌症。2022年,肺癌新发病例高达248.1万例,占据了全球癌症新增病例的12.4%。在国内,肺癌亦是发病率最高的癌种。其中,非小细胞癌(NSCLC)是最常见的肺癌类型,占所有肺癌病例的约85%。
间变性淋巴瘤激酶(ALK)基因融合是非小细胞肺癌(NSCLC)的重要驱动基因,在约5-7%的NSCLC患者中发生,基于NSCLC庞大的患者群体,ALK融合阳性患者数量不容小觑。针对ALK融合基因的靶向治疗已成为此类患者的主要治疗策略,作为一线治疗方案写入了中国临床肿瘤学会(CSCO)以及美国国立综合癌症网络(NCCN)制定的治疗指南。

药融圈获悉,Ficonalkib(SY-3505)是首药控股(北京)股份有限公司自主研发的第三代ALK激酶抑制剂(TKI),是国内首个进入临床研究,也是目前进度最快的国产第三代ALK-TKI。
临床前及早期临床研究结果均表明Ficonalkib对野生型ALK及多种耐药突变(如L1196M、G1202R等)具有显著活性,展现出良好的疗效与安全性。目前,Ficonalkib在ALK阳性晚期NSCLC初治患者中对比克唑替尼的关键III期临床研究(NCT06254599)正在有序推进,旨在评估其有效性及安全性。
根据最新披露的信息,该研究中有一例ALK阳性晚期NSCLC伴随脑转移的初治患者,在接受Ficonalkib治疗后,所有病灶均实现了完全缓解。
该患者为55岁男性,于2021年12月确诊为ALK阳性肺腺癌。患者先后接受了两周期的新辅助化疗(培美曲塞+卡铂)、根治性手术和术后放疗,以及术后两周期辅助化疗(培美曲塞+卡铂)。2024年6月复查时,胸部CT显示右肺下叶术后条状高密度影,右侧胸膜结节状增厚伴少量积液,两肺多发实性小结节。头颅增强CT显示右侧额叶有结节状强化灶,考虑为脑转移。
2024年7月4日,患者入组Ficonalkib关键III期临床研究。基线影像学评估显示右肺下叶存在可测量靶病灶,另有肺部多个非靶病灶,包括两肺多发结节、右侧胸膜结节及少量胸腔积液。头颅MRI显示右侧额叶存在非靶病灶。
NGS基因检测结果显示肿瘤组织中存在EML4(外显子6)- ALK(外显子20)框内融合(NM_019063.5, NM_004304.5),符合ALK靶向治疗标准。
该患者符合Ficonalkib III期临床试验的入组标准,接受每日一次600 mg剂量的Ficonalkib胶囊口服治疗,每3周为一个给药周期。治疗6周后,增强CT和脑部MRI结果显示患者右肺下叶靶病灶完全消失,颅内非靶病灶完全消失(图1)。但肺部多发小结节、右侧胸膜结节及胸腔积液仍存在。根据实体瘤疗效评价标准(RECIST v1.1),患者达到部分缓解(PR)。
患者继续接受治疗,12周后的影像学检查显示,所有靶病灶和非靶病灶(包括肺部及头颅病灶)均完全消失(图1),患者达到完全缓解(CR)。表明Ficonalkib对该患者的肿瘤具有显著的抑制作用。
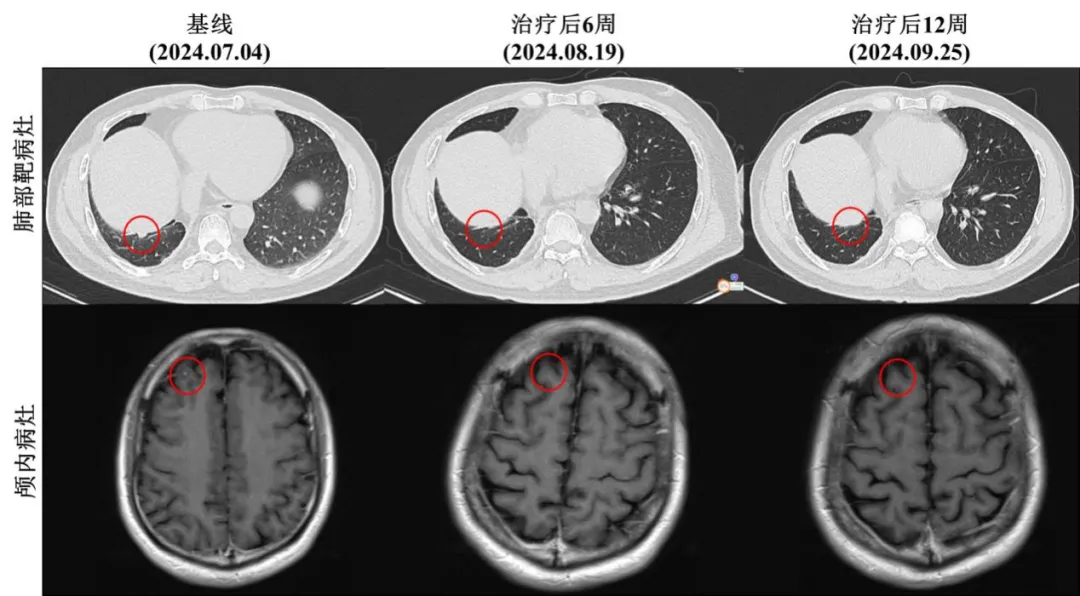
图1 | 患者在Ficonalkib治疗期间各病灶不同时间点的影像学检查结果
后续患者将继续接受Ficonalkib治疗,并按照临床试验方案规定,定期进行影像学检查以监测疗效。随访计划包括定期的增强CT和头颅MRI,以确保及时发现复发或新病灶。
该病例的治疗结果表明,患者在接受每日600 mg Ficonalkib口服治疗12周后,影像学评估显示所有肿瘤病灶(包括靶病灶和非靶病灶)均完全消失,达到了完全缓解。患者的颅内病灶在治疗后6周内完全消退,且未出现新发病灶。这一结果在ALK融合基因阳性且伴有脑转移的初治患者中具有重要的临床意义,表明Ficonalkib不仅迅速控制了原发肿瘤及其转移病灶,还在短期内实现了全面缓解,特别是在颅内病灶的治疗方面显示出显著疗效。此外,患者在治疗期间的不良反应轻微,主要表现为1-2级的胃肠道反应和肝功能异常,整体耐受性良好。这一案例为Ficonalkib作为一线治疗ALK阳性晚期NSCLC的潜在应用价值提供了支持,为后续临床试验的开展提供了有力的保证。
据了解,首药控股是国内首个同时拥有二代、三代 ALK 激酶抑制剂的创新药企,能够满足 ALK阳性非小细胞肺癌患者从一线、二线到三线及以上线数的序贯治疗需求,未来有望实现ALK阳性非小细胞肺癌患者全流程用药管理。
在非小细胞肺癌这一大病种治疗领域,首药控股重点布局了多款候选药物,除了前文提到的三代ALK/LTK抑制剂Ficonalkib(SY-3505)之外,还包括二代ALK/FAK抑制剂康太替尼(CT-707/SY-707)、首个完全国产的高选择性RET抑制剂SY-5007、高活性KRAS(G12C)抑制剂SY-5933等,靶点覆盖面广泛。
就在最近,该公司肺癌管线又迎来好消息。
10月23日,首药控股宣布收到国家药品监督管理局下发的《受理通知书》,公司完全自主研发的康太替尼颗粒(CT-707,申报商品名:首要泽®)单药适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者治疗的新药上市申请(NDA)获得受理。

CT-707(SY-707)是首药控股完全自主研发的第二代ALK激酶抑制剂。2024年上半年,CT-707治疗ALK阳性NSCLC患者的关键性III期临床试验完整数据读出,主要研究终点结果达到方案预设的优效标准。与对照组相比,CT-707在治疗ALK阳性NSCLC患者中取得了显著且有临床意义的改善,安全性方面同样展现出独特的优势,未来有望丰富我国ALK阳性NSCLC患者的治疗选择,进一步提高国内患者的用药可及性。
SY-5007是国内第一个完全自主研发的选择性RET抑制剂,已披露的临床数据显示其在RET阳性非小细胞肺癌患者(包括初治和经治患者)显示了优异的抗肿瘤活性且安全性良好。目前首药控股已经完成针对RET阳性非小细胞肺癌的关键临床II和III期试验的受试者入组工作,一些关键数据也将陆续读出。按照预计SY-5007将于2025年上半年申报NDA,有望成为国内第一个实现商业化的RET抑制剂。
首药控股是国内唯一一家同时拥有KRAS(G12C)抑制剂(SY-5933)和FAK抑制剂(CT-707/SY-707)的创新药企,临床前研究显示二者在KRAS(G12C)突变的多种肿瘤模型中具有显著的协同抑制活性。随着后续临床试验的开展,该联用组合未来会在多种KRAS(G12C)突变肿瘤的一线治疗中发挥极大潜力。

药融圈此前报道,首药控股是一家小分子创新药企业,成立于2016年,在小分子创新药领域深耕了多年。随着公司研发管线的持续推进,首药控股多款产品陆续进入关键临床阶段,公司逐渐从Biotech向BioPharma转型。(潜心修行,浮出水面:新药研发劲旅首药控股将登陆科创板)
如今的首药控股正逐渐步入商业化兑现期,这一“新药研发劲旅”正朝着“造中国患者能够吃得起的一类新药”的愿景加速迈进。
参考:
NMPA/CDE;
药融云数据www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);
http://www.shouyaoholding.com/index.php;
https://share.gmw.cn/yp/2024-10/24/content_37634557.htm;
https://open.sseinfo.com/ir2/indexkcb?language=zh_CN&stockCode=688197;等等

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-22
2025-12-22
 31
31

 产业资讯
产业资讯
 医药笔记
医药笔记  2025-12-22
2025-12-22
 29
29

 产业资讯
产业资讯
 CGT分享家
CGT分享家  2025-12-22
2025-12-22
 32
32