 研发追踪
研发追踪
 医药速览
医药速览  2024-12-09
2024-12-09
 1404
1404
基于一项名为 ADRIATIC 的 III 期临床试验,阿斯利康的Imfinzi(durvalumab)可显著延长局限期小细胞肺癌 (LS-SCLC) 患者的总生存期和无进展生存期,美国食品药品监督管理局 (FDA) 于 2024 年 12 月 4 日批准 Imfinzi 用于治疗经同步铂类化疗和放疗后未进展的 LS-SCLC 成人患者。

Imfinzi 是一种 PD-L1 抑制剂,通过阻断 PD-L1 与 PD-1 和 CD80 蛋白的相互作用来对抗肿瘤的免疫逃避策略,从而释放对免疫反应的抑制。ADRIATIC 试验是一项随机、双盲、安慰剂对照、多中心全球 III 期临床试验,在 19 个国家/地区的 164 个中心招募了 730 名患者,他们被随机分配接受 Imfinzi 单药治疗、Imfinzi 联合 AstraZeneca 的抗 CTLA-4 抗体 Imjudo (tremelimumab) 治疗,或安慰剂治疗。试验的主要终点是 Imfinzi 单药治疗组与安慰剂组之间的总生存期 (OS) 和无进展生存期 (PFS)。
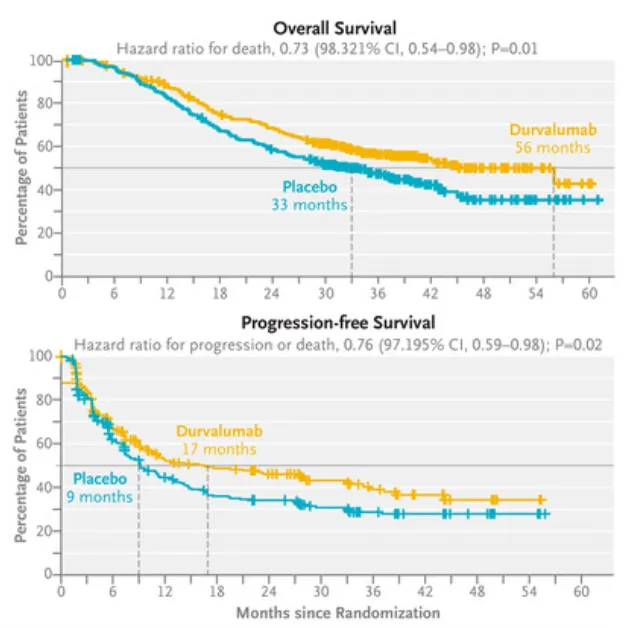
结果显示,Imfinzi 单药治疗组在 OS 和 PFS 方面均表现出统计学意义和临床意义上的显著改善:
●总生存期 (OS): Imfinzi 组的中位 OS 为 55.9 个月,而安慰剂组为 33.4 个月。这意味着与安慰剂相比,Imfinzi 使死亡风险降低了 27%。在三年生存率分析中,Imfinzi 组的 OS 率为 56.5%,而安慰剂组为 47.6%。
●无进展生存期 (PFS): Imfinzi 组的中位 PFS 为 16.6 个月,而安慰剂组为 9.2 个月。
Imfinzi 的安全性良好,3 级或 4 级不良事件发生率在各治疗组之间相似,约为 24%。导致停药的不良事件发生率分别为 16.4% 和 10.6%。任何级别的免疫介导不良事件发生率分别为 32.1% 和 10.2%。放射性肺炎或肺炎的发生率分别为 38.2% 和 30.2%。超过五分之一接受 Imfinzi 治疗的患者出现的最常见不良反应是肺炎、放射性肺炎和疲劳。

 研发追踪
研发追踪
 药时代
药时代  2026-02-13
2026-02-13
 6
6

 研发追踪
研发追踪
 医药魔方
医药魔方  2026-02-13
2026-02-13
 6
6

 研发追踪
研发追踪
 瞪羚社
瞪羚社  2026-02-13
2026-02-13
 8
8