 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-02-18
2025-02-18
 1933
1933
2 月 17 日,信达生物宣布其 PD-1/IL-2α-bias 双特异性抗体融合蛋白 IBI363 获得 FDA 授予快速通道资格,拟定适应症为抗 PD-(L)1 免疫检查点抑制剂及含铂化疗治疗后进展的局部晚期或转移性鳞状非小细胞肺癌。值得一提的是,这是继黑色素瘤后,IBI363 再次获得 FDA 快速通道资格认定。

截图来源:企业官微
IBI363 是信达生物自主研发的全球首创 PD-1/IL-2 双特异性融合蛋白,同时具有阻断 PD-1/PD-L1 通路和激活 IL-2 通路两项功能。IBI363 的 IL-2 臂经过了设计改造,保留了其对 IL-2 Rα 的亲和力,但削弱了对 IL-2Rβ 和 IL-2Rγ 的结合能力,以此降低毒性;而 PD-1 结合臂可以同时实现对 PD-1 的阻断和 IL-2 的选择性递送。
由于新激活的肿瘤特异性 T 细胞同时表达 PD-1 和 IL-2α,这一差异性策略可以更精确和有效地实现对该 T 细胞亚群的靶向和激活。IBI363 不仅在多种荷瘤药理学模型中展现出了良好抗肿瘤活性,在 PD-1 耐药和转移模型中也表现出了突出的抑瘤效力。
在 2024 年 WCLC 上,信达曾公布 IBI363 在既往接受过免疫治疗的鳞状非小细胞肺癌受试者中的积极结果:
在 3 mg/kg 剂量组至少随访 12 周以上或已结束研究的患者中(n=18),ORR(客观缓解率)为 50.0%,DCR(疾病控制率)为 88.9%。中位 PFS(无进展生存期)未达到,仍在随访中;
而在 1/1.5 mg/kg 剂量组中,中位 PFS 达 5.5 个月 (95% CI: 1.5, 8.3),12 个月 PFS 率为 30.7%,显示出免疫治疗的长期获益优势;
在 1/1.5/3 mg/kg 剂量组中,PD-L1 TPS<1%(n=22)的受试者和 TPS≥1% (n=22) 的受试者 ORR 分别为 36.4% 和 31.8%,提示 IBI363 在 PD-L1 低表达人群中的潜在优势。
Insight 数据库显示,除了已经被 FDA 授予快速通道资格的黑色素瘤和鳞状非小细胞肺癌适应症以外,IBI363 还被开发用于 T 细胞淋巴瘤、胆道癌、结直肠癌、胰腺癌等。从靶点来看,目前全球共有 31 款 PD-1/IL2 靶向药物在研,信达 IBI363 是研究进展最快的一款药物,已经进入临床 II 期。此外,还有 11 款也进入临床阶段,研究进展较快的来自于罗氏、盛禾、再生元和 Anaveon。
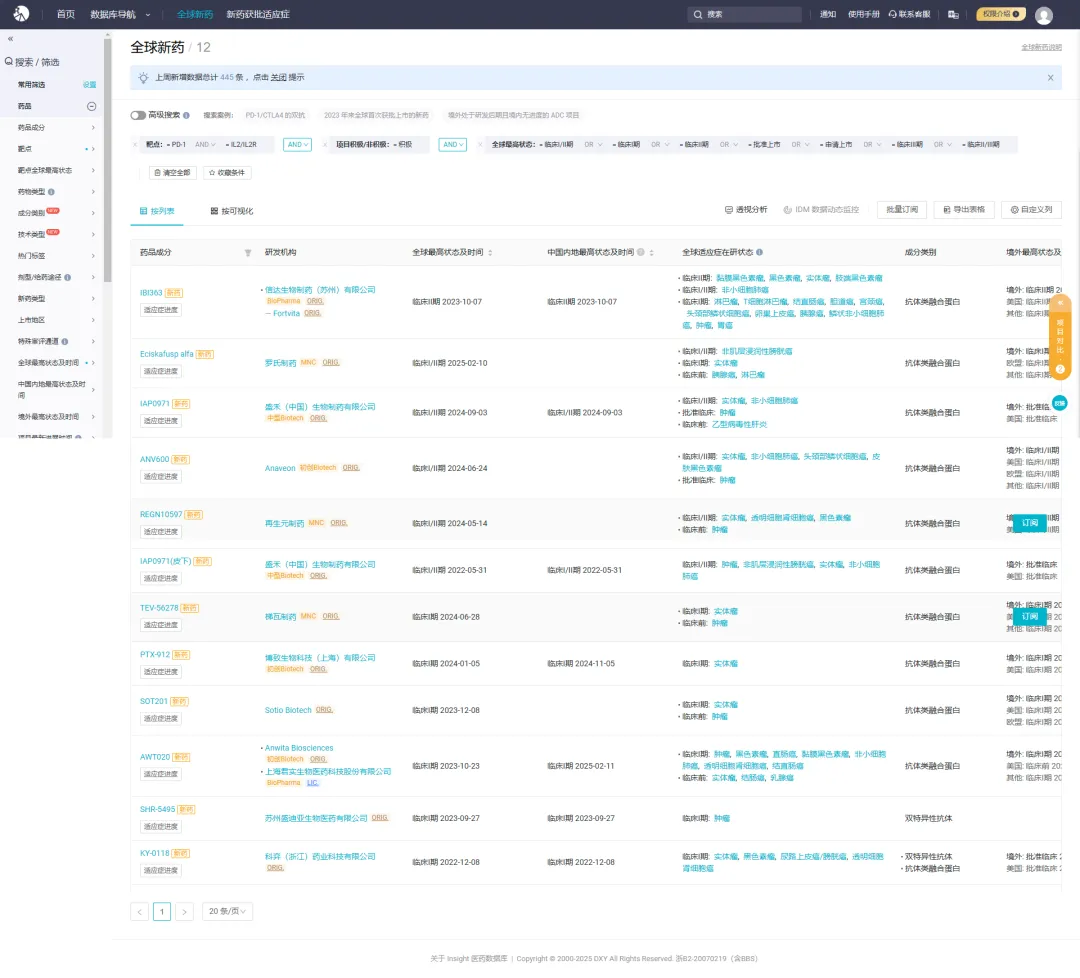
截图来源:Insight 数据库

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 145
145

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 150
150

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 137
137