 产业资讯
产业资讯
 药渡Daily
药渡Daily  2025-02-26
2025-02-26
 2319
2319
2023年ASCO期间,百利天恒报告了全球首创的EGFR/HER3双抗ADC药物BL-B01D1的首次临床数据,139例患者整体评估的客观缓解率ORR达到45.3%,38例EGFR突变非小细胞肺癌患者的ORR更是高达63.2%,是迄今为止全球最优的数据。
BL-B01D1基于其创新的结构设计和亮眼的临床数据,横空出世般成为了当届ASCO会议最受关注的药物之一,百利天恒随后也迎来多个高光时刻。
2023年12月,百利天恒与BMS就BL-B01D1达成了首付8亿美元总额84亿美元,成为迄今为止全球ADC领域单个资产总交易额最大的全球战略许可及合作交易,公司市值一度超过千亿元。
然而成功显然不是一夜之间取得的,当时光回到2014年,这家以中成药和仿制药业务为主的公司,在美国西雅图创建了SystImmune子公司,集合创新人才,全力转向创新药物的开发,从开发全球了首个四特异性抗体,再到开发全球独创双抗ADC药物,可谓十年磨一剑。
截止到目前,百利天恒已经有8款ADC药物进入临床阶段,两款已经进入III期临床阶段,并对ADC平台进行多种迭代开发,从横空出世到引领全球ADC药物研发,百利天恒用了不到3年的时间,本文简要对其ADC药物开发进行梳理。
百利天恒临床阶段ADC药物研发管线
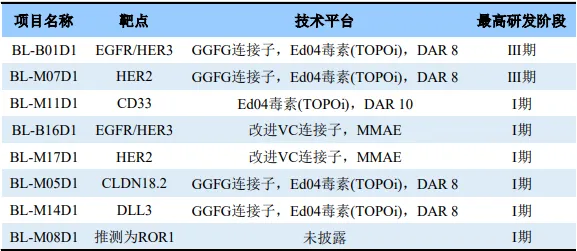
来源:CDE
1
BL-B01D1
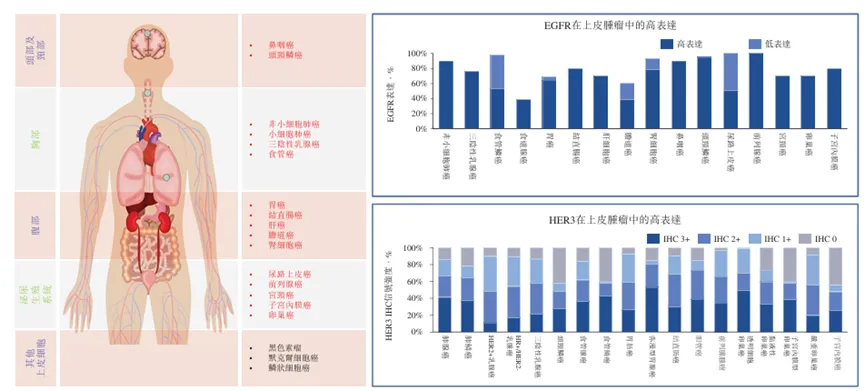
全球首创的EGFR/HER3双抗ADC药物BL-B01D1,最大的核心显然是其立项依据。首先EGFR和HER3在多种实体瘤中具有同步表达,具有协同性。EGFR和HER3在多种实体瘤中的表达
来源:百利天恒招股说明书此外,经典EGFR靶向疗法最大的问题在于耐药性。EGFR可以和多种配体结合,且一旦内吞,配体-受体复合物可以循环到细胞表面。EGFR/HER3双抗ADC通过结合两个受体更好地调节细胞内运输,从而增强有效载荷的细胞内释放,显著克服耐药性。
BL-B01D1代谢特性
来源:百利天恒招股说明书
在结构设计方面,BL-B01D1同样巧妙。两个靶点的抗体采用了差异化的亲和力设计,以提高其偏向性的结合能力,同时Fc区域采用的野生性的igG1,通过Fc的效应细胞改善药物分布以及提高免疫反应。ADC设计方面,此在采用自主开发的拓扑异构酶毒素Ed-04,在第一三共的Dxd的α亚酰氨处进行了改进,连接子采用GGFG,DAR值为8。
BL-B01D1结构与功能
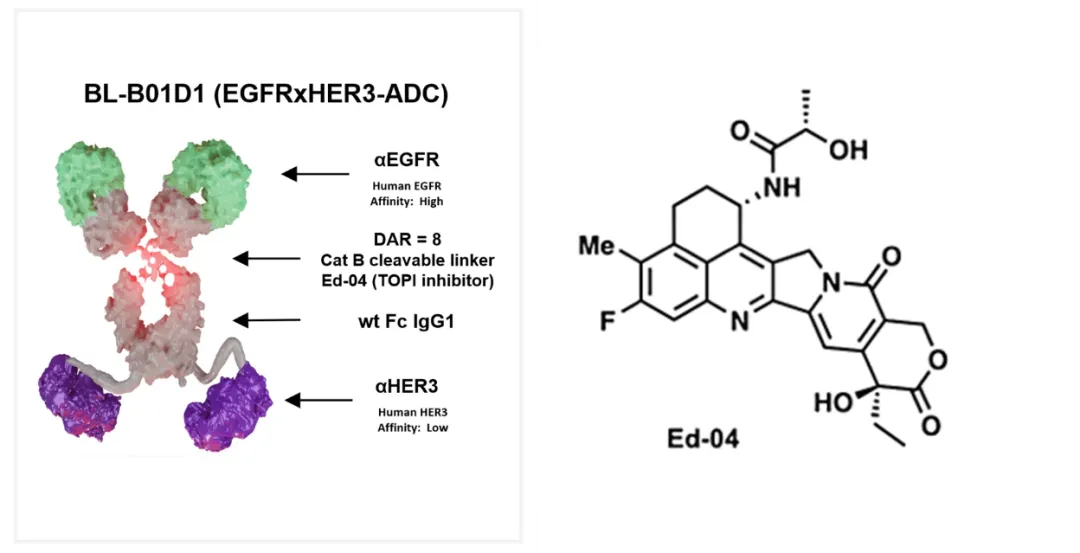
来源:整理于百利天恒官网
BL-B01D1于2021年11月开始开展首次人体I期临床研究,截止到目前已经在乳腺癌、非小细胞肺癌、小细胞肺癌、胃肠道癌和鼻咽癌等多种癌种中启动了8项单药或联合治疗的III期临床试验,在多项临床试验现已累积入组了2000多名患者。
2023年ASCO会议期间,BL-B01D1首次公布了人体I期临床研究结果,在38例EGFR突变的非小细胞肺癌患者中取得了63.2%的响应率,特别是还有34例患者接受过第三款如EGFR TKI治疗,其也成为迄今为止EGFR突变的非小肺癌最高的响应率,显著高于HER3 ADC、EGFG ADC和EGFR/c-Met双抗等新型疗法。
BL-B01D1非小细胞肺癌临床数据比较
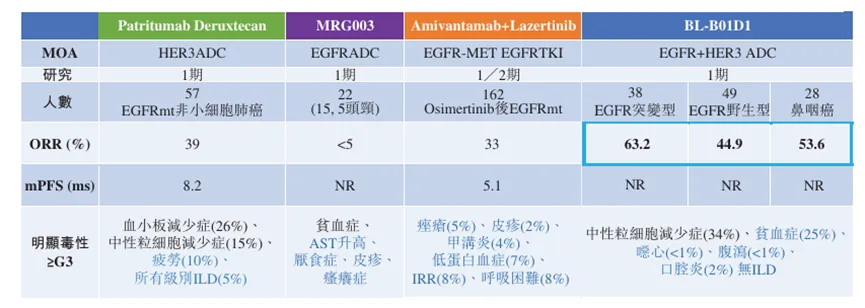
来源:百利天恒招股说明书
随后再多个学术会议期间,百利天恒也再次更新了其它如胃肠道癌、尿路上皮癌和乳腺癌等多个适应症的I期临床数据,BL-B01D1均在多个临床适应症中均显示了不俗的响应数据,疾病控制率和中位PFS均较为客观,目前在这些癌种中也均启动了III期临床试验。
BL-B01D1其它癌种初步有效性数据
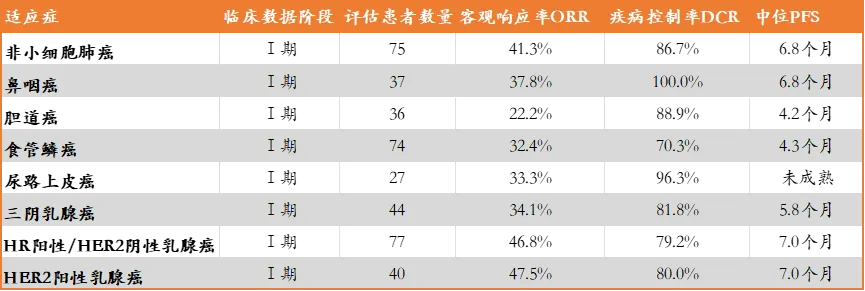
来源:2024 ESMO,2024 SABCS
安全性方面,I期初步研究的结果表明,BL-B01D1常见的治疗相关不良事件(TRAE>10%,所有级别≥3级)包括白细胞减少症、 贫血、中性粒细胞减少症、血小板减少症、恶心、虚弱、食欲减退、脱发、呕吐等。所报告的大多数TRAE为轻度至中度,可通过支持治疗或剂量调整得到有效控制。
值得注意的是,截至2023年8月17日,接受此I期临床试验的369名患者中仅呈报一例2级间质性肺炎的病例。
BL-B01D1初步安全性数据
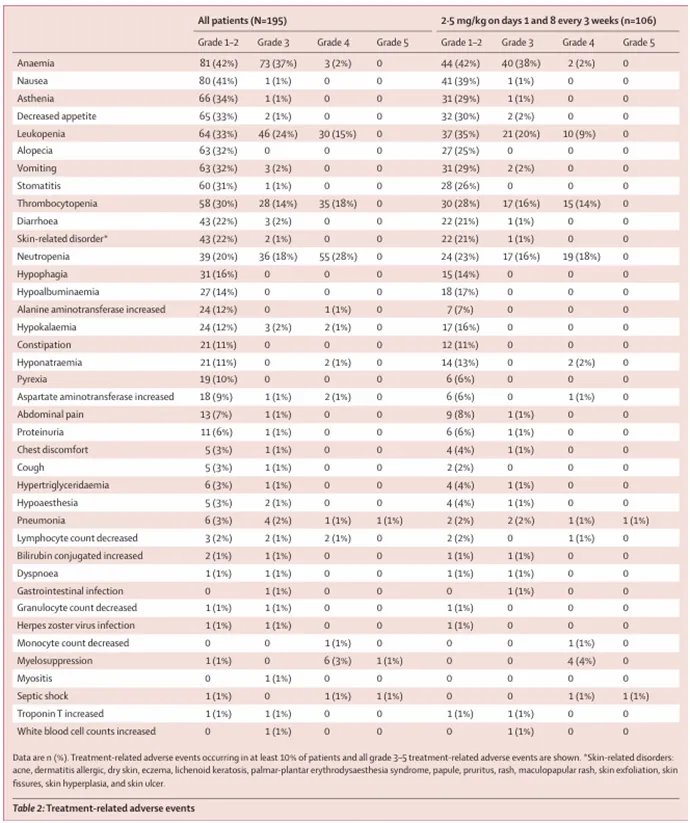
来源:Lancet Oncol. 2024 Jul;25(7):901-911
BL-B01D1目前正在中国及美国进行约30项临床试验,以评估BL-B01D1用于治疗十余种癌症适应症的疗效,同时启动了8项单药或联合用药的III期临床试验,同时基于对EGFR和HER3的生物标志物研究分析,未来也有望在泛癌种的临床中取得突破。
BL-B01D1在早期临床中的生物标志物探索分析
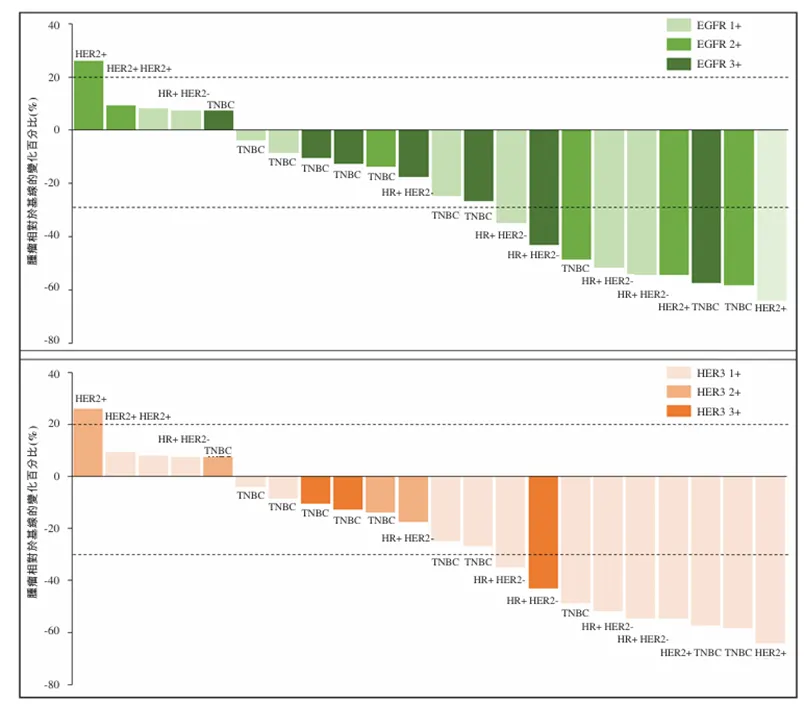
来源:百利天恒招股说明书
基于BL-B01D1颠覆性的临床数据,2023年12月百利天恒和百时美施贵宝就EGFRxHER3双抗ADC BL-B01D1达成8亿美金首付款机潜在总价值84亿美元的交易,创造了迄今为止全球ADC领域单个资产总交易额最大的全球战略许可及合作交易,也掀开了百利天恒在ADC药物领域的高速发展序幕。
2
BL-M07D1
HER2 ADC药物BL-M07D1是百利天恒第2款进入临床阶段的ADC药物,其采用了曲妥珠抗体,同样采用了采用自主开发的拓扑异构酶毒素Ed-04进行偶联,GGFG作为连接子,DAR值为8。
BL-M07D1于2022年5月首次进行临床试验申请,目前已经启动10项临床试验,包括两项与T-DM1头对头比较的III期临床试验,尽管HER2 ADC药物研发竞争激烈,BL-M07D1仍然处于第一研发阵营。
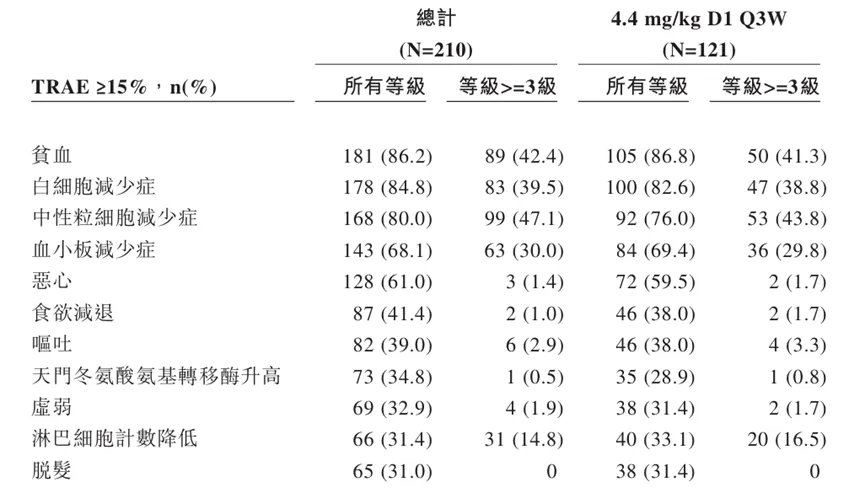
2023年ESMO会议期间,百利天恒首次公布了BL-M07D1在局部晚期或转移性HER2表达乳腺癌及其他实体瘤患者的人体数据,随后也进行了数据更新。截止到2024年7月1日,有98名可评估的局部晚期或转移性HER2表达乳腺癌患者接受4.4mg/kg D1 Q3W剂量水平的BL-M07D1治疗。
在45名HER2+乳腺癌患者中,BL-M07D1确认的客观响应率为84.4%,疾病控制率为100%。在16名在BL-M07D1之前接受过HER2-ADC的HER2+乳腺癌患者中,确认的客观响应率为87.5%,疾病控制率为100%。在53名HER2低表达乳腺癌患者中,确认的客观响应率为54.7%,疾病控制率为94.3%,这一数据优于其它在临床阶段的同类ADC药物。
BL-M07D1在I期临床有效性数据
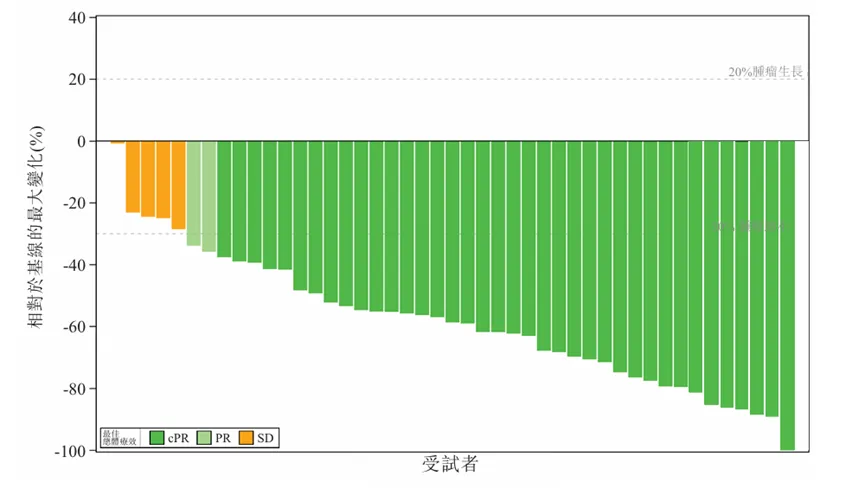
来源:百利天恒招股说明书
安全性方面,截止到2024年7月1日,BL-M07D1观察到的毒性主要为血液学毒性。观察到四个间质性肺炎病例,仅有一个为3级。此外未观察到与药物相关的死亡,相关不良反应均可控,耐受性良好。
BL-M07D1在I期临床部分安全性数据
来源:百利天恒招股说明书
目前BL-M07D1分别HER2阳性乳腺癌的晚期二线治疗、以及新辅助阶段,分别启动了一项和罗氏HER2 ADC药物T-DM1的头对头对比的III期临床试验,后者也是也是目前国内最大患者规模的T-DM1头对头临床试验,显示了百利天恒对BL-M07D1推进决心。
3
BL-M11D1
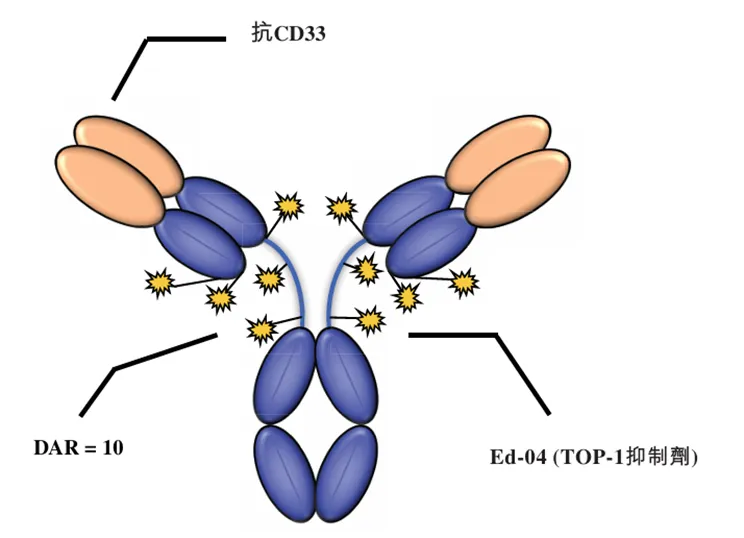
BL-M11D1为靶向CD33的ADC药物,也是百利天恒管线中唯一一款针对血液瘤的ADC药物,目前在中美均在开展一项I期多中心临床。目前全球仅有一款靶向CD33的ADC药物Gemtuzumab ozagamicin,由辉瑞开发用于CD33阳性急性髓系白血病(AML)患者治疗,Gemtuzumab ozagamicin采用的毒素为卡奇霉素衍生物。BL-M11D1采用和辉瑞一样的吉妥珠单抗,为了进一步提高了毒素的偶联率,其还将部分氨基酸突变为半胱氨酸,采用拓扑异构酶抑制剂毒素Ed-04进行偶联, DAR值高达10。
BL-M11D1的产品结构
来源:百利天恒招股说明书
除了在CD33阳性急性髓系白血病中进行早期探索,BL-M11D1还在头颈鳞癌和乳腺癌等多种实体瘤患者中进行开创性的临床探索,未来同样值得期待。
两款产品进入临床III期阶段后,百利天恒也对其平台进行了迭代,以应对ADC药物的耐药性和敏感性,分别针对EGFR/HER3双抗和HER2单抗开发了第2款ADC药物BL-B16D1和BL-M17D1,目前均处于临床I、期阶段。
两者均以MMAE为代表的微管抑制剂毒素进行搭建,并对VC双肽连接子进行了改造,从毒素的羟基位点引入连接子,在和抗体的链接接头处进行了酸化处理。接头酸化一方面减少逆迈克尔加成带来的毒素提前脱落,另一方面也可以增加连接子的亲水性,可以使传统微管抑制剂ADC的DAR值也提高到8,在高载药下亲水性更好、高载药值下血浆稳定性更好,药效方面更有优势。
专利数据显示,同阳性药如以MC-VC-MMAE为linker-payload的ADC相比,使用更低的剂量即可达到同等肿瘤抑制效果,MTD有所提高,且神经毒性和血液毒性降低。
除了创新的MMAE/F平台,百利天恒还公布了艾日布林的毒素平台专利,同样区别于传统的C35位氨基上引入linker,创新性地从C34位羟基引入linker,以提高毒素的亲水性和稳定性。
一方面在首代药物方面进行迭代开发,另一方面也将平台快速孵化其它半成熟的ADC药物靶点,进行了CLDN18.2和DLL3相关ADC药物的开发,目前均处于临床I期。BL-M08D1没有披露靶点信息,但目前已经在多种实体瘤和血液瘤中分别开展一项I期临床,从靶点特性推测为一款ROR1的ADC药物开发,同时从剂量推测应该同样为一款拓扑异构酶抑制毒素构建的ADC药物,期待这几款ADC药物后续的临床更新。
综上所述,百利天恒基于EGFR/HER3双抗ADC药物BL-B01D1的横空出世,十年磨一剑,从名不见经传的传统药企一跃成为全球ADC药物研发的焦点,BL-B01D1未来更是有望成为年销售额超过100亿的泛肿瘤治疗的基石药物。
同时百利天恒凭借其强大的研发平台和丰富的产品管线,在ADC药物开发领域已经展现出巨大潜力,未来有望在肿瘤治疗市场中占据重要地位,改写中国biotech的研发格局。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 82
82

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 70
70

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 64
64