 产业资讯
产业资讯
 人在药途
人在药途  2025-02-28
2025-02-28
 1240
1240
与上一篇文章【ADC的未来:回顾2024,展望2025】一样,再次搬运Beacon数据库ADC平台的相关总结,这次是关于ADC连接子的发展。
抗体-药物偶联物(ADC)连接子——连接抗体和有效载荷的分子桥梁——是ADC疗效和不良反应的关键决定因素。理想情况下,连接子应在进入癌细胞后特异性释放有效载荷,同时在循环系统中保持稳定,从而扩大治疗窗口。这种看似矛盾的稳定性和释放要求是连接子开发中的一个主要挑战。ADC性能的提高和批准数量的增加依赖于将抗体和有效载荷连接起来的化学物质的重大发展。
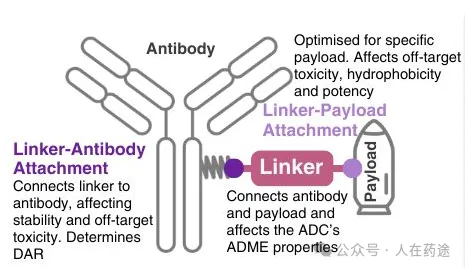
第一代ADC存在药物-抗体比率(DARs)不均一和连接子不稳定的问题,使其效果较差、毒性较高,且其影响不可预测。这张信息图探索了从早期连接子到第三代和最新一代ADC中所用化学物质的演变,突出了为特定抗体和有效载荷选择最佳连接子的重要性。
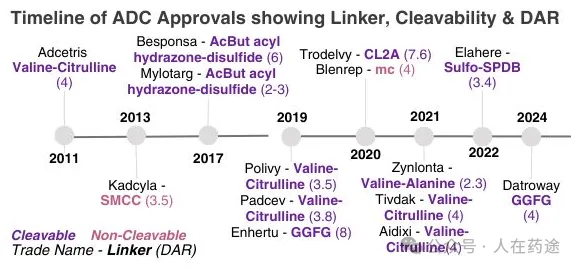
ADC批准的时间表,显示连接子、可切割性和DAR
可切割VS不可切割连接子
连接子可大致分为两类:不可切割和可切割。不可切割连接子在ADC发生分解代谢时释放有效载荷,而可切割连接子仅在特定条件下(如暴露于特定酶或低pH值)时才释放其有效载荷。如下图所示,可切割连接子倾向于在全身稳定性和细胞内有效载荷释放之间取得最佳平衡,因此越来越受欢迎。此外,除两种已批准的ADC外,所有其他ADC都使用可切割连接子。
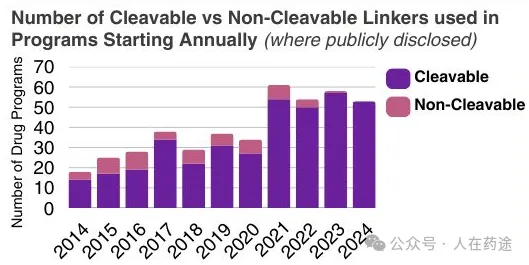
起始计划中使用的可切割与不可切割连接子的数量(公开披露)
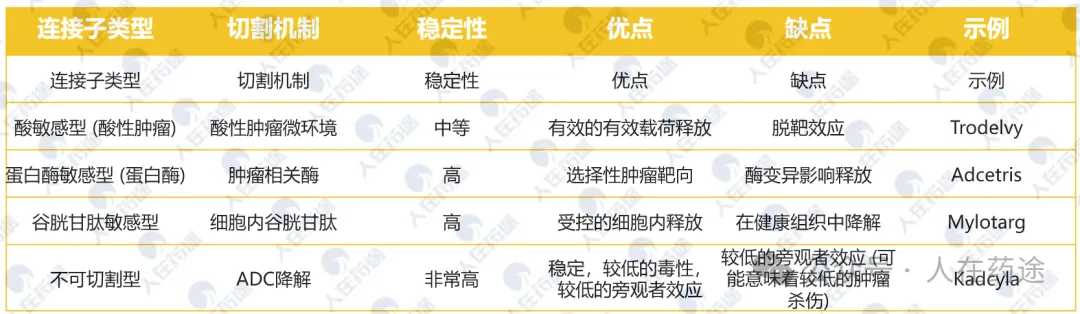
连接子类型、切割机制、稳定性、优点、缺点和示例
表格总结了不同连接子类型的属性,包括酸敏感型、蛋白酶敏感型、谷胱甘肽敏感型和不可切割型,并列出了每种连接子的优点、缺点和示例。
最常用的可切割连接子是缬氨酸-瓜氨酸(Val-Cit),用于167个项目中,其中88个项目目前处于活跃状态,5个项目已获得上市许可。Val-Cit连接子被组织蛋白酶B切割,这种蛋白酶在癌细胞中高度表达,但也对多种其他组织蛋白酶表现出广泛的敏感性,这可能导致对正常细胞的脱靶毒性。第二种最常用的可切割连接子是β-葡糖苷酸,由葡糖苷酸酶触发,葡糖苷酸酶在溶酶体中含量丰富且在某些肿瘤中过度表达。这种连接子可产生稳定的ADC,并且β-葡糖苷酸的高亲水性可降低ADC的聚集
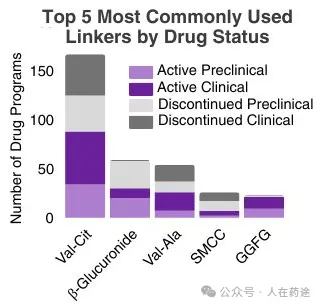
药物状态排名前 5 位的最常用连接子
偶联化学
需要优化的一个重要方面是连接连接子与抗体的偶联化学。
位点特异性偶联(SSC)已成为ADC开发的新标准,标志着随机偶联时代的结束。虽然目前批准的14种ADC中只有2种使用SSC技术,但自2022年以来,已有238种新的基于SSC的ADC进入开发管道,没有新的随机偶联候选物出现,景观发生了巨大的变化。这种向SSC的转变是由其关键优势驱动的:生产具有一致DAR的均一ADC。这提高了批次间的一致性、重现性并降低了免疫原性。
值得注意的是,59种具有β-葡糖苷酸连接子的ADC中有42种使用ConjuAll™,这是一种下一代平台技术,在之前的信息图中被标记为脱颖而出。ConjuAll™使用新型连接子化学与位点特异性酶偶联相结合,以赋予连接子稳定性和有效载荷释放。由大田生物科学公司开发的LigaChem Biosciences的ConjuAll™已成为26项交易的焦点,平均潜在交易总额为6.2亿美元,其中包括安进和武田等获得许可的公司。
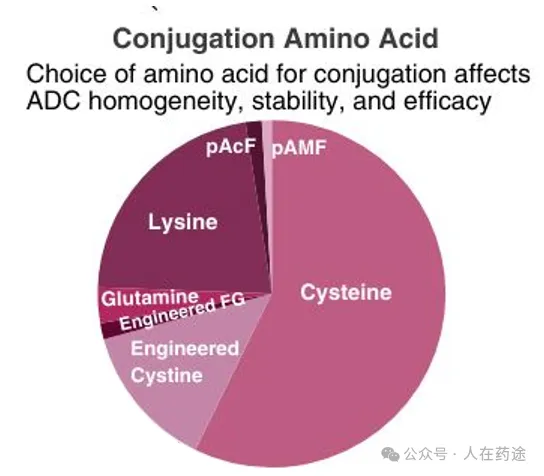
偶联氨基酸——氨基酸的选择会影响ADC的均一性、稳定性和疗效。
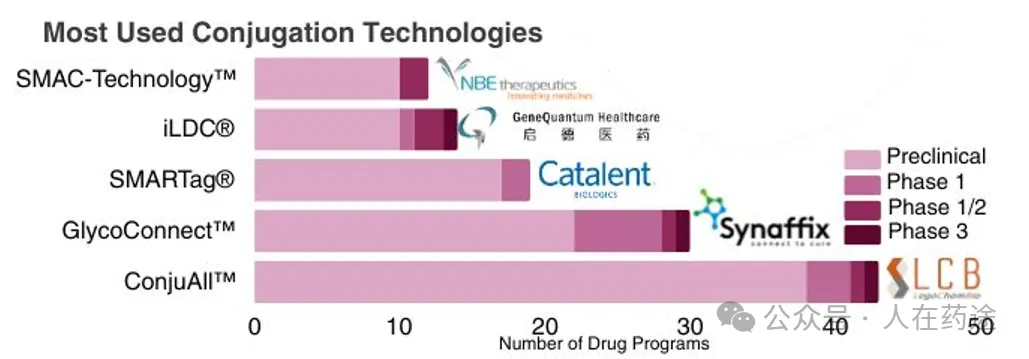
最常用的偶联技术
ADC连接子分析技术
可以在ADC连接子开发中优化的参数有很多,这既是机遇也是挑战。评估ADC连接子的性能非常困难,需要一种多方面的方法,正如左侧ADC计划中使用的广泛的体外测定所强调的那样。
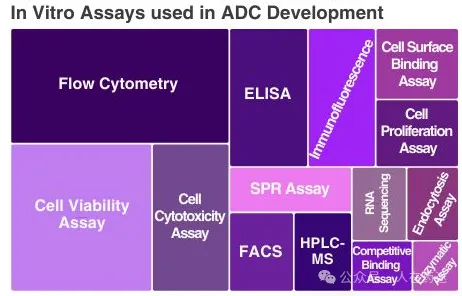
用于ADC连接子开发的关键分析技术
结合和特异性: ELISA、表面等离子共振、细胞表面和竞争结合测定
内化和有效载荷释放: 流式细胞术、免疫荧光、内吞作用测定、质谱、HPLC、Western印迹、FACS、酶法测定、RPPA
细胞毒性和功能效应: MTT/ATP、CCK-8、增殖测定、膜联蛋白V、CellTiter-Glo®、细胞因子珠测定、qRT-PCR、RNA测序
ADC连接子的未来
双重触发连接子——触发:2个肿瘤特异性信号,影响:减少脱靶效应
生物正交连接子——外部触发激活(例如光),影响:可定制的递送
自组装连接子——适应肿瘤环境,影响:增强渗透
免疫调节连接子——释放免疫激活剂,影响:双重作用疗法
新兴的创新,如双重触发连接子、生物正交激活系统和自组装连接子,有望实现前所未有的肿瘤特异性、控制释放和更广泛的治疗应用,尽管它们尚未被证明在临床上安全有效。除了传统的ADC外,连接子还在其他药物偶联物的开发中发挥着关键作用,如放射性偶联物,其中DOTA等螯合剂能够将放射性同位素稳定地连接到抗体上。作为靶向部分和治疗有效载荷之间的关键桥梁,下一代药物偶联物的成功将取决于连接子技术的不断创新。
最后,原文奉上:


 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 133
133

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 139
139

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 129
129