 产业资讯
产业资讯
 中国医药创新促进会
中国医药创新促进会  2025-03-01
2025-03-01
 1511
1511
引言
当全球生物医药产业驶入深水区,创新药“出海”已不仅是企业扩张的必选项,更是中国医药产业升级的战略支点。日本作为全球第三大医药市场,与中国药企在靶点开发、成本控制方面优势互补,成为中国创新药企出海的重要一站。
中国医药创新促进会始终致力于深化中日医药产业合作,并在医药创新领域取得了一系列实质性成果。为全面助力中国药监、生物技术公司、投资界深入了解日本药品监管法规、申报流程、沟通交流以及生产和检查等相关事宜,我会联合研发客、上海市生物医药科技产业促进中心以及泰格医药,共同开设“出海日本”专栏,特邀日本法规监管领域的资深专家发布专业性文章。撰稿人包括著名的药品开发及监管专家植村昭夫博士、东内祥浩先生和高野哲臣先生。同时还将对日本政府、学术界以及中日两国业内专家进行访谈,共同探讨开发及监管热门话题。
中国药促会中日医药合作交流
联系人:马明尧
电话:13520846026
邮箱:mamy@phirda.com
在本专栏的系列B中,将由植村昭夫博士和东内祥浩先生共同负责介绍日本药品监管制度的基本信息。本篇文章是该系列的第一篇,将谈一谈构成日本药品监管行政基础的药监部门。
拓展阅读:医药研发达人中文版“出海日本”首期:日本临床试验的历史(上)
01日本药监部门
1) 厚生劳动省厚生劳动省(Ministry of Health, Labour and Welfare,以下简称MHLW)负责制定和实施与国民健康相关的各项政府政策。其中,药品监管是MHLW的重要职责之一,由MHLW作出关于药品的最终判断(例如,生产销售批准、安全性措施等决策)(兽药由农林水产省管辖)。
2) 独立行政法人药品医疗器械综合机构独立行政法人药品医疗器械综合机构(Pharmaceuticals and Medical Devices Agency,以下简称PMDA)于2004年4月1日成立,是MHLW管辖的涉及药品和医疗器械的独立行政法人。MHLW负责政策和行政的最终决策等,而PMDA则负责根据MHLW的方针实施和推行政策。换言之,PMDA开展药品、医疗器械等生产销售注册申请的审评、安全对策、健康损害救济这三项业务(图1)。
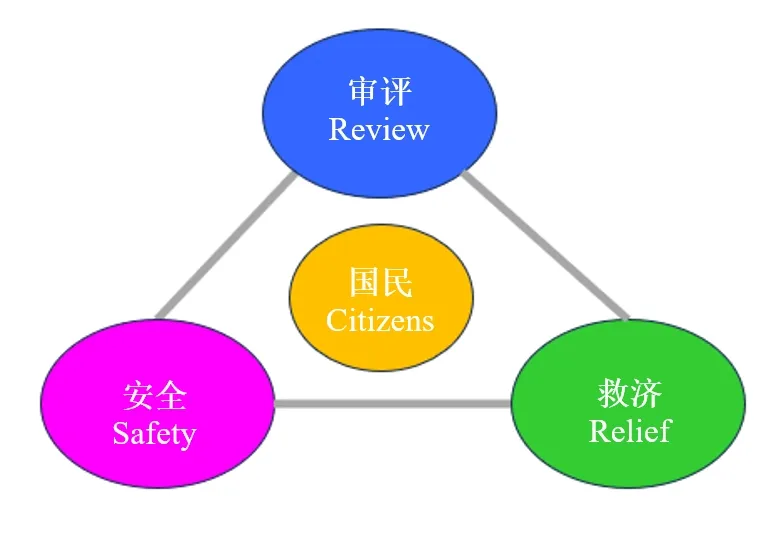
图1 用于确保质量、有效性和安全性的PMDA安全三角(Safety Triangle)
(引用自https://www.pmda.go.jp/about-pmda/outline/0001.html,有改动)
在药品、医疗器械等项目的审评过程中,监管部门与申请人(制药企业等)的关系如图2所示。申请人向PMDA进行注册申请,PMDA就会对申报资料进行审评和检查。期间,PMDA会发出问询,申请人要提交答复。PMDA会将审评内容汇编成审评报告,提交给厚生劳动省(厚生劳动大臣),由其决定能否批准。
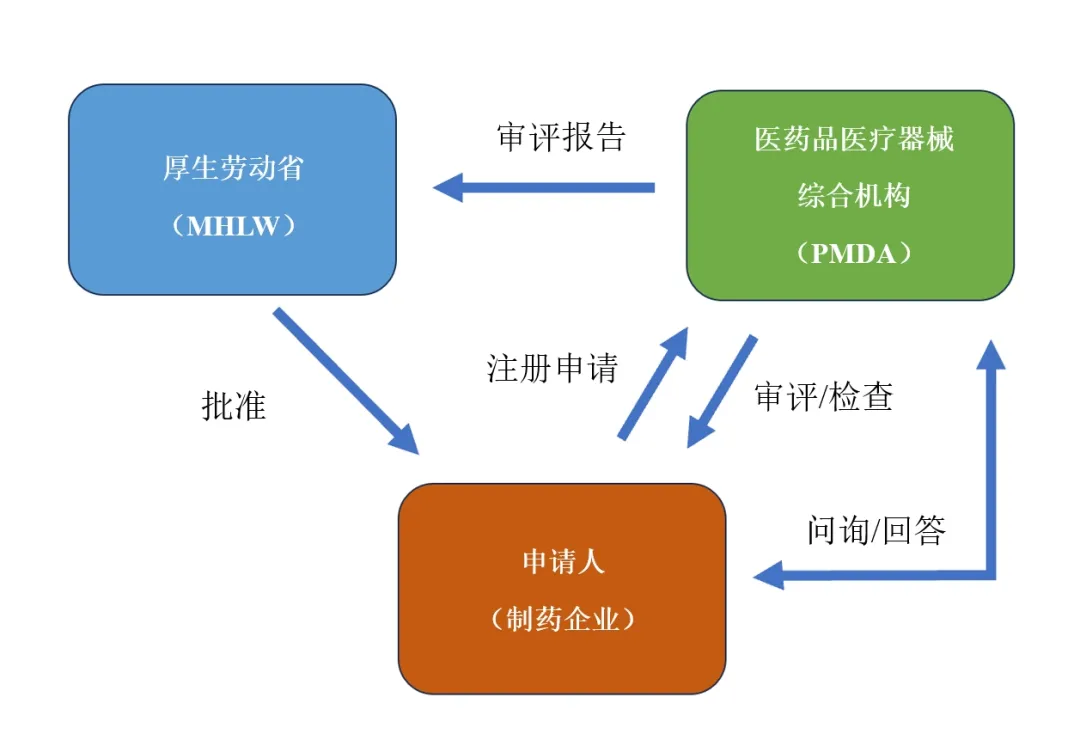
图2 厚生劳动省、PMDA与申请人的关系
(引用自https://www.pmda.go.jp/files/000219906.pdf,有改动)
笔者精选信息1
日本近期医药动态之药物错失
截至2023年3月,有143种药品已在欧美获批但尚未在日本获批,在这些未获批药品中,有86种(60.1%)还未在日本国内着手开发,暂无进行申报的计划。这就是所谓的药物错失。
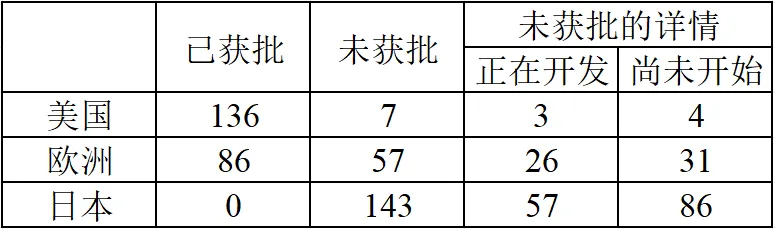
2023年6月9日药品快速稳定供应综合对策专家研讨会报告参考资料
02厚生劳动省(MHLW)的业务和组织
本节将介绍厚生劳动省中管辖药品相关业务的部门中主要涉及药品注册申请的组织及其所管事务。
1) 医药局 负责与国民生命健康息息相关的各种问题,包括确保药品、医药部外品、化妆品、医疗器械等卫生用品和再生医疗等产品的质量、有效性和安全性的措施,同时,还包括血液事业、麻醉药品和兴奋剂的相关措施等。与药品等开发相关的主要负责科室及其负责业务如下所示。
① 审评管理课•与药品等的生产许可及上市批准相关的事项。 •与孤儿药品(中国的罕见疾病药物)、突破性治疗药品及特定用途药品(不包括体外诊断试剂)的认定相关的事项。 •与PMDA进行的对药品等的注册申请审评、检查相关的事项。
② 监视指导•麻药对策课•与劣质药品等、医疗器械等或违法标示的药品等、医疗器械等的管制相关的事项。 •与药品等、医疗器械等的进口确认相关的事项。 •与药品等、医疗器械等的广告相关的事项。 •与药品等、医疗器械等的检验和检定相关的事项。 •与麻醉药品、精神药品、大麻、鸦片和兴奋剂管制相关的事项。
2) 医政局 应对近年来人口老龄化、疾病结构变化、国民要求优质医疗的呼声高涨等问题,策划并起草有助于构建优质高效医疗供给体制的政策。与药品等开发相关的主要负责科室及其负责业务如下所示。
① 研发政策课•与药品、医药部外品、化妆品、医疗器械等卫生用品及再生医疗等产品的研究和开发相关的事项。 ② 临床试验推进室 •与推进临床试验相关的事项。
(译者注:在日本政府的组织架构中,“部”是高层级单位,通常负责一个较大的职能领域或业务板块。“课”是中层级单位,负责具体的业务或职能。“室”是基础单位,通常负责更具体或专业化的任务。)
03独立行政法人医药品医疗器械综合机构(PMDA)的业务和组织
PMDA是于MHLW医药局管辖下的一个组织,负责审评申请人提交的注册申请资料(审评)。此时,该组织将检查所实施的临床试验在伦理和科学上的可靠性(可靠性检查),以及药品等的生产方法和生产体系的合规性(GMP/QMS/GCTP检查)。此外,该组织还会在产品注册申请前开展关于各种试验的方法和评价标准等的“咨询业务”,为申请人提出建议,促进药品等的开发顺利进行。本节将介绍与审评相关的业务和组织。
1) 审评业务的内容
① 与临床试验等相关的咨询业务
② 药品、医疗器械、再生医疗等产品等的审评业务
③ 再审查/再评价业务
④ 与注册申请资料等的内容相关的可靠性检查业务
⑤ 针对生产厂的GMP/QMS/GCTP等检查业务
GMP:Good Manufacturing Practice,药品和医药部外品生产质量管理规范
QMS:Quality Management System,医疗器械和体外诊断试剂生产质量管理规范
GCTP:Good Gene, Cellular, and Tissue-based Products Manufacturing Practice,再生医疗等产品生产质量管理规范
⑥ 针对注册认证机构的检查等业务
⑦ 日本药典等的标准制定调查业务
2) 负责审评业务的主要部门
① 审评业务部
② 审评管理部
③ 新药审评一部至五部根据注册申请适应证的不同,按以下领域进行审评。
第1领域:消化系统用药、皮肤用药、免疫抑制剂、其他(无法归为其他任一领域的)
第2领域:循环系统用药、抗帕金森病药、抗阿尔茨海默病药
第3领域-1:中枢神经系统用药、外周神经系统用药。但不包括麻醉用药。
第4领域:抗菌药、抗病毒药(不包括涉及艾滋病药品领域的)、抗真菌药、抗原虫药、驱虫药
第5领域:泌尿生殖系统及肛门用药、处方药的复方制剂
第6领域-1:呼吸系统用药、抗过敏药(不包括皮肤用药)、感官用药(涉及炎症性疾病的)
第6领域-2:激素制剂、代谢性疾病用药(糖尿病、骨质疏松、痛风、先天性代谢异常等)
放射性药品领域:放射性药品
抗恶性肿瘤药物领域:抗恶性肿瘤药
④ 再生医疗产品等审评部
⑤ 疫苗等审评部
⑥ 仿制药等审评部
⑦ 可靠性保证一部、二部
⑧ 医疗器械审评一部、二部
⑨ 医疗器械独立软件审评部
⑩ 体外诊断试剂审评室
3) 审评的基本思路
① 应确保所实施的临床试验和所提交的资料的可靠性
② 根据适当设计的临床试验结果可以客观判断产品具备有效性(例如,有效性优于安慰剂)
③ 根据所得的临床试验结果,应可以判断药品等具有临床价值
④ 与获益相比应无不可接受的风险
⑤ 从确保质量的角度来看,应能够保证具有一定有效性和安全性的药品等的持续稳定供应
⑥ 计划作为上市后安全对策的内容应是合理的
笔者精选信息2
日本、美国和欧洲的新药审评时间
关于NME(New Molecular Entity,新分子实体),2022年批准品种的审评时间(中位数)为日本10.8个月、美国11.0个月、欧洲14.0个月,日本与美国的审评时间(中位数)基本相同。
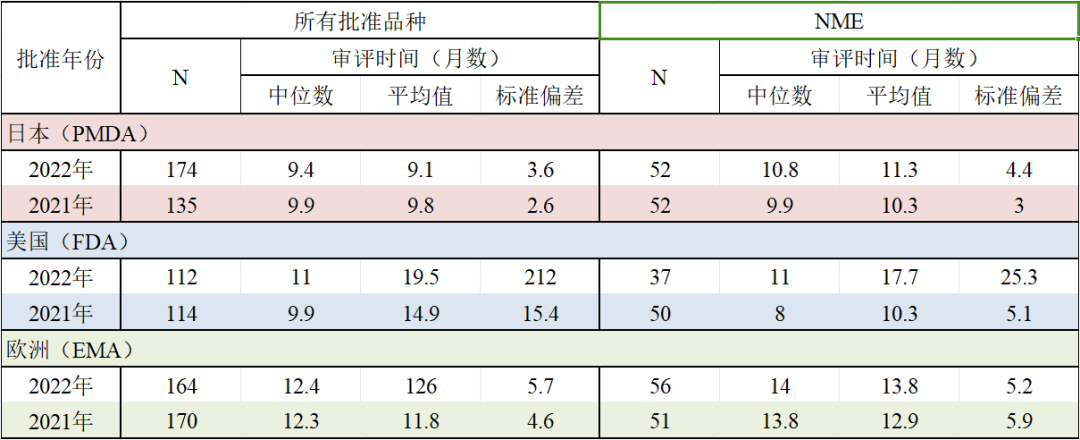
来源:政策研新闻 第70期 2023年11月
04
厚生劳动省管辖的其他组织
1) 国立研究开发法人医药基础•健康•营养研究所(主管局等:大臣官房)在药品技术及医疗器械等技术方面,通过开展有助于药品和医疗器械等以及药用植物及其他生物资源开发的通用型研究,以及振兴民间等地的研发等业务,为药品技术及医疗器械等技术的提升夯实基础,并通过开展关于维持和增进国民健康的调查研究以及关于国民营养等国民饮食生活的调查研究等,力求公共卫生的改善及增进,进而为提升国民保健水平做出贡献。
① 基础技术研究和创新药研发支持
② 生物资源研究和创新药研发支持
③ 药品等的开发振兴
④ 关于维持和增进国民健康的调查研究
⑤ 关于国民营养等国民饮食生活的调查研究
⑥ 食品营养生理学试验
2) 国立医药品食品卫生研究所(主管局等:大臣官房)
对于药品等的质量、安全性和有效性,制定和规范评价方法,并开展相关试验和研究。此外,还进行有关管制药物及植物的试验和研究、探索有关严重不良反应等的生物标志物和阐明不良反应发生原因等的研究以推进药品等的合理使用并确保安全性。
3) 独立行政法人国立医院机构(主管局:医政局)
通过提供医疗服务、开展医疗调查研究和培训技术人员等业务,力求提升对国民健康有重大影响的疾病相关医疗服务,以及国家医疗政策中机构应承担的其他医疗服务,从而为改善和增进公共卫生做出贡献。
除了上述三个组织以外,厚生劳动省还管辖着以下多个组织:
4) 国立研究开发法人国立癌症研究中心(主管局等:大臣官房)
5) 国立研究开发法人国立循环系统疾病研究中心(主管局等:大臣官房)
6) 国立研究开发法人国立精神•神经医疗研究中心(主管局等:大臣官房)
7) 国立研究开发法人国立国际医疗研究中心(主管局等:大臣官房)
8) 国立研究开发法人国立成育医疗研究中心(主管局等:大臣官房)
9) 国立研究开发法人国立长寿医疗研究中心(主管局等:大臣官房)
10) 独立行政法人地区医疗功能推进机构(主管局:医政局)
11) 独立行政法人劳动者健康安全机构(主管局:劳动标准局安全卫生部)
12) 独立行政法人劳动者退休金共济机构(主管局:就业环境•平等就业局)
13) 独立行政法人老年人•残疾人•求职者就业支援机构(主管局:就业保障局)
14) 独立行政法人福利医疗机构(主管局:社会•援助局)
15) 独立行政法人国立重度智能障碍者综合设施希望之园(主管局:社会•援助局残障保健福利部)
16) 养老金公积金管理运用独立行政法人(主管局:年金局)
17) 独立行政法人劳动政策研究•培训机构(主管局:政策统筹官)
 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 129
129
 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 136
136

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 126
126