 产业资讯
产业资讯
 IQVIA艾昆纬
IQVIA艾昆纬  2025-03-19
2025-03-19
 1357
1357
近年来,全球药物研发逐步转向以患者为中心的理念。这一转变不仅是源于政策推动,也是因患者需求变化和技术进步而形成的必然趋势。CDE(中国国家药品监督管理局药品审评中心)和FDA(美国食品药品监督管理局)在这一理念上的高度一致性,也促使申办方需要尽早理解政策导向并及时做出相应调整。本文旨在总结和梳理FDA和CDE的相关政策,深入了解其指导方向及具体实施指导。
01FDA以患者为中心药物研发相关政策梳理1–9
2006年,FDA发布了《关于患者自报结果应用于新药研发和疗效评价的指南(草案)》,首次鼓励在临床疗效评价与药物试验报告中包含患者报告结局(PRO),以测量干预措施对患者健康状况的影响10。以此为起点,2018年至2023年间,四部以患者为中心的药物研发(PFDD)指南系统逐步成熟。在历时17年的过程中,FDA推动全球制药企业将研发重点锚定于实际临床需求,实现从“申办方主导”向“患者赋权”的过渡。
FDA以患者为中心的药物研发政策概览

02CDE以患者为中心药物研发相关政策梳理11–18
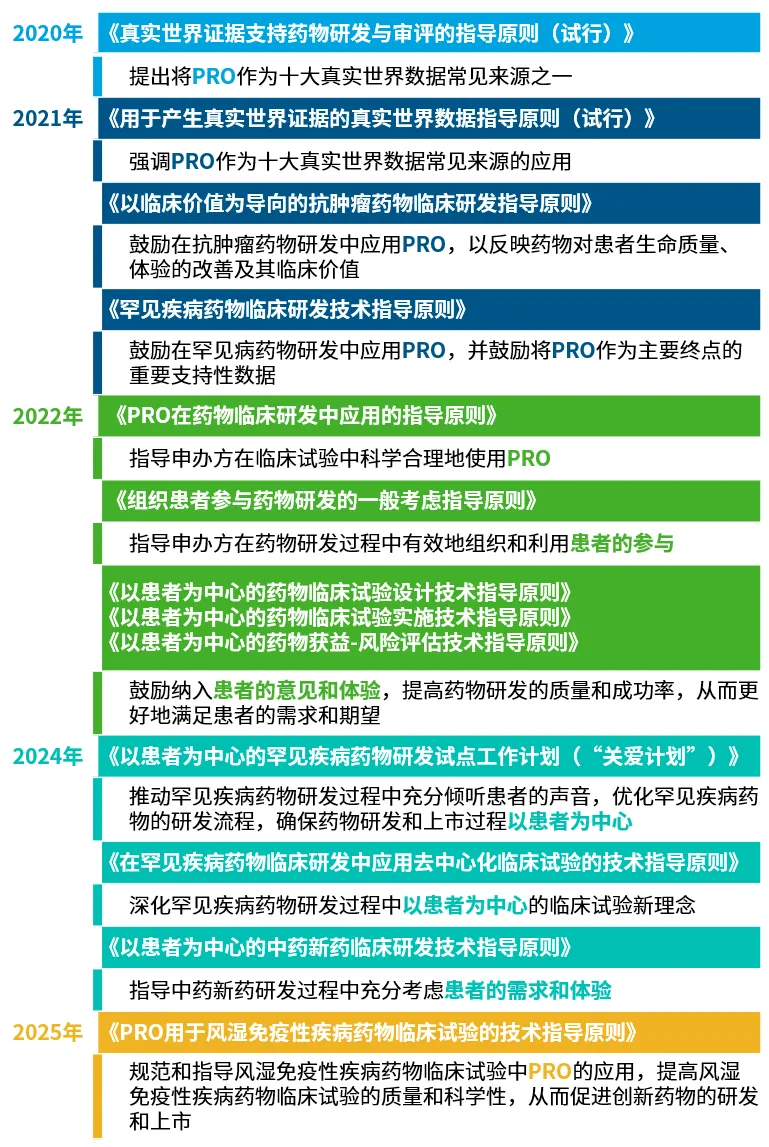
2020年,CDE在《真实世界证据支持药物研发与审评的指导原则(试行)》中首次将PRO纳入十大真实世界数据来源之一19。2022年成为关键转折年,从首个PRO专项指导文件到PFDD三部曲,PRO成为我国药品审评审批的重要指标之一,试验设计到实施全链条绑定患者需求,实现“患者需求-数据采集-审评决策”闭环20,21。CDE以政策推动行业转型——当疗效终点由实验室指标转向患者实际获益,中国创新药的竞争规则得以重新定义。
CDE以患者为中心的药物研发政策概览
03FDA对比CDE:以患者为中心药物研发相关政策异同点
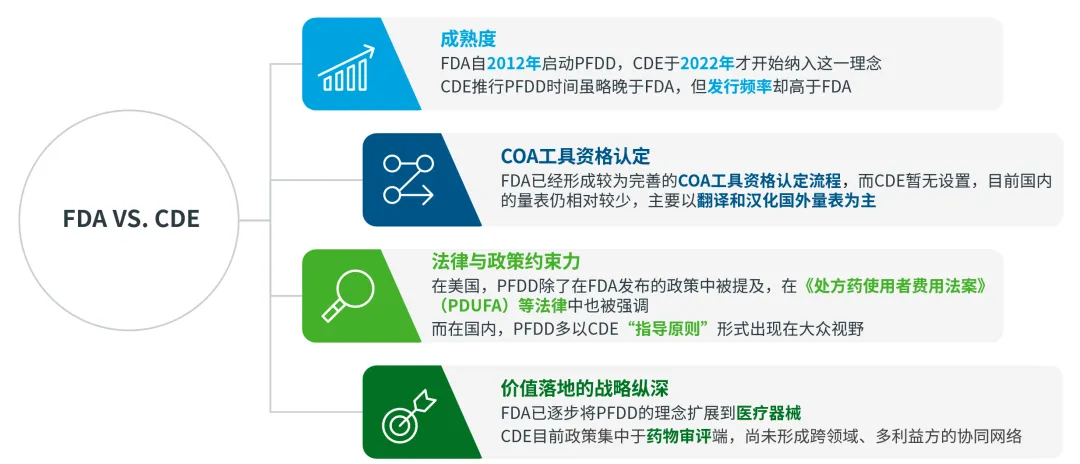
总体而言,FDA和CDE在以患者为中心的药物研发政策上“同”大于“异”,主要包括:
两者都提倡“以患者为中心的药物研发”,强调关注患者需求,将患者视为积极参与者,并涵盖药物生命周期的各个阶段。
FDA和CDE建议申办方在药物全生命周期中的多个环节收集患者体验数据,包括但不限于临床结果评估(COA)、定性数据(例如访谈)、定量数据(例如调查问卷)。
对于PED收集的方法和质量提出具体要求,并发布了相应的技术指南,尤其是COA部分,涉及到新COA开发、已有COA翻译、文化调试以及改进流程和标准。
FDA与CDE在患者为中心药物研发中的政策差异
04结语:未来竞争的核心
以患者为中心的发展趋势对申办方提出了更高的要求。及时响应政策的号召,快速做出调整,已成为申办方成功的重要考量。在政策优先级领域(如肿瘤、自身免疫疾病),申办方可以通过患者参与的临床试验设计(如调整终点指标、优化随访流程)来回应未被满足的临床需求。同时,可以将“患者声音”转化为监管认可的证据(如COA、定性数据、定量数据),从而在疗效竞争中脱颖而出,并在同类产品中建立独特的疗效证明力。后续我们还将分享欧美地区的实践经验,助力加速中国“以患者为中心药物研发”的落地,敬请期待!

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 66
66

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 75
75

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 66
66