 产业资讯
产业资讯
 药融圈
药融圈  2025-04-04
2025-04-04
 623
623
减重概念美股biotech年初又来一家。
伴随着今年IPO市场回暖的迹象,2025年2月,Aardvark Therapeutics成功登陆纳斯达克,股票代码“AARD”,成为今年第五家纳斯达克IPO的生物制药公司。此次IPO发行价16美元,发行588.8万股,募资总额为9421万美元。

Aardvark
Therapeutics是一家临床阶段的生物制药公司,专注于开发新型小分子疗法,以激活先天的稳态途径来治疗代谢性疾病。该公司开发的新药靶向与缓解饥饿相关的生物学路径,有望为患者带来变革性的结果。
尽管GLP-1疗法已成为“风靡全球”的降糖减重药物,但其局限性(如胃肠道副作用、需注射给药、瘦体重减少、停药后体重反弹等)为新作用机制、新组合和新配方打开了机会之门。
用“苦味”对抗饥饿
Aardvark的候选化合物通过靶向苦味受体TAS2Rs,来治疗与饥饿相关的适应症。
苦味是五种基本味觉之一,苦味感受在生物体的生存中扮演着至关重要的角色,它帮助生物体识别并避免摄入有害毒素和令人不快的物质。
TAS2Rs(味觉受体2型家族)是一组由26种不同的营养感应G蛋白偶联受体(GPCRs)组成的家族,在脊椎动物中广泛表达。这些受体不仅在口腔中存在,用于传达苦味感受,而且在身体许多其他组织中也高度表达,对于调节代谢和炎症通路至关重要。
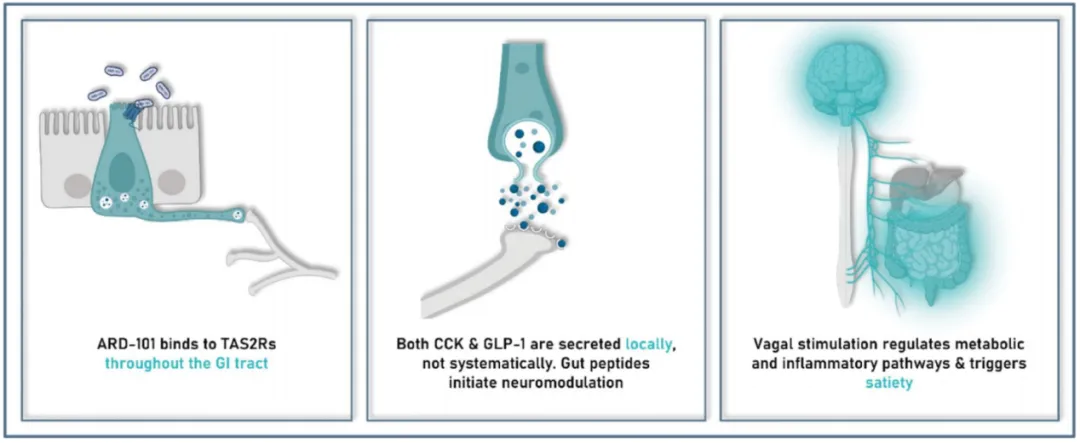
在肠道中,TAS2Rs通过多种机制帮助控制食欲和体重:激活肠道内分泌细胞上的TAS2Rs时,会触发CCK(胆囊收缩素)和GLP-1(胰高血糖素样肽-1)等肽类激素的释放。这些激素随后通过迷走神经的感觉纤维或直接通过血液循环向大脑发送信号,以控制饱腹感和食物摄入。TAS2Rs的激活还能调节肠道的运动性,有助于改善消化过程,并可能对整体代谢产生积极影响。TAS2Rs的激活还可以减少前脂肪细胞的增殖与分化,有助于减少体内脂肪积累。
CCK(胆囊收缩素)作为一种有前景的药物靶点已被认可多年,因为它的释放与进食有关,并有助于抑制饥饿感。这种对饥饿感的抑制有望成为GLP-1疗法的补充,进而减少摄食量。然而,以往艾伯维、阿斯利康、GSK和诺和诺德等企业通过外源性分子直接激动CCK受体的方法受到全身暴露导致的安全性问题的限制,导致脱靶毒性,进而引发胰腺炎等不良反应。
走进减重“无人区”
据企业招股书披露,目前全球范围内除了Aardvark的候选化合物外,没有其他靶向特定TAS2Rs的药物已获批或处于临床阶段。这是迷人又危险的“无人区”。
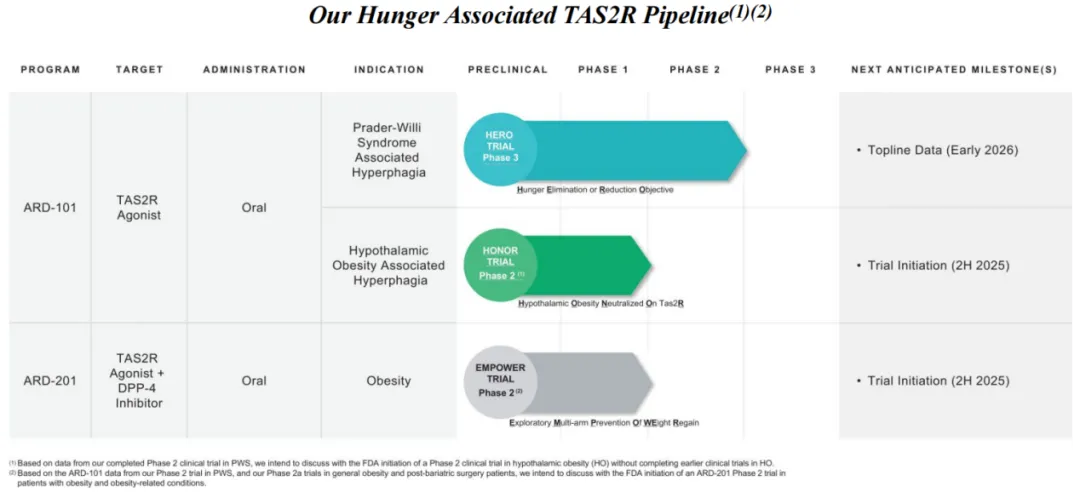
Aardvark的主要候选产品ARD-101是一种口服肠道限制性小分子激动剂,靶向肠腔中表达的特定TAS2Rs。
ARD-101由乙酸地那铵一水合物盐组成,是迄今为止发现的最有效的TAS2R激动剂之一。ARD-101在肠道周围区域局部诱导CCK的表达,选择性地诱导迷走神经肠-脑轴信号,避免了过往使用全身暴露人工CCK类似物分子的脱靶副作用。在该公司此前开展的临床前研究和临床试验中,发现ARD-101仅作用于肠道,全身暴露很少(~1%),并且在所有剂量水平上都耐受性良好。因此ARD-101有望提供一种更具有解剖学针对性和选择性的方法来调整CCK信号的作用。
快速入局:以罕见病为突破口
目前,ARD-101正在被开发用于治疗两种罕见病:Prader-Willi综合征(PWS,俗称小胖威利综合征)和下丘脑性肥胖(HO)相关食欲亢进。
PWS是一种遗传性神经发育障碍,由父系15号染色体上的某些基因表达缺陷引起。全球估计有35万至40万名PWS患者。患者最明显的症状是严重的暴饮暴食。PWS患者的中位寿命为30年,与肥胖相关的并发症仍然是导致死亡的主要原因。
在此前开展的2期临床试验中,ARD-101在治疗PWS方面显示出强大的疗效信号,包括减少饥饿感和体脂成分。12名患者中有11名在28天内使用HQ-CT(临床试验食欲亢进问卷)评估时,贪食症状减轻,平均减轻7分,并显示出行为上的改善。12名受试者中有4名患者饥饿症状几乎完全消失。
Aardvark在2024年12月启动了ARD-101治疗PWS相关食欲亢进的潜在关键3期临床试验,称为HERO研究(Hunger Elimination or Reduction Objective),预计将在2026年初公布顶线结果。与此同时,该公司还扩大了临床管理和监管能力,包括招聘临床、监管和质量人员。PWS患者因无法控制食欲需终身监护,ARD-101若成功,则有望减少家庭与社会负担,改变PWS相关的暴饮暴食的治疗前景。
【竞争对手Soleno Therapeutics的PWS候选药物DCCR(二氮嗪胆碱)缓释片剂将在2025年3月底迎来FDA的新药审评决定】
下丘脑性肥胖(HO)是一种罕见的肥胖形式,在美国大约有5000~10000名患者。多种下丘脑病理生理学可导致与HO相关的暴饮暴食,在接受过颅咽管瘤治疗的患者中发病率最高。HO和PWS的解剖学和表型表现在许多方面都是相似的,包括下丘脑功能受损、神经元通路受损、神经递质活性改变和食欲亢进。此外,这两种适应症目前还没药物干预措施被批准用于控制暴饮暴食。这也强调了这类疾病与其他形式的肥胖症的区别,因为PWS和HO主要是由饥饿信号驱动。
通过与FDA的讨论,Aardvark计划开展一项针对HO相关食欲亢进的2期临床试验,研究名称为HONOR试验(Hypothalamic Obesity Neutralized On TAS2R),给药时间约4个月。
另据摩熵医药数据显示,ARD-101已经获得了孤儿药和罕见儿科疾病用药资格认定,用于治疗PWS。
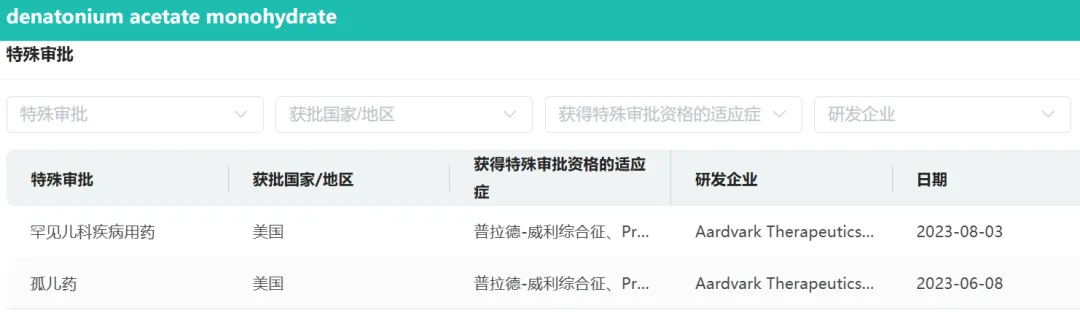
图源:摩熵医药数据
野心布局:瞄准普通肥胖市场
Aardvark的另一款候选产品ARD-201是该公司专有的TAS2R激动剂ARD-101与DPP-4(二肽基肽酶Ⅳ)抑制剂的固定剂量组合,用于治疗一般性肥胖和肥胖相关疾病,拟设计为每日口服给药一次。
DPP-4是治疗2型糖尿病的一个成熟靶点,目前市场上已有多种DPP-4抑制剂,如西格列汀、维格列汀等,其作用是抑制肠促胰素的降解,包括GLP-1。抑制DPP-4可使内源性肠促胰素水平全身性增加,这支持了与TAS2R激动剂的潜在协同作用。Aardvark此前开展的临床前研究表明,TAS2R激动剂ARD-101与DPP-4抑制剂联用对体重减轻具有附加效应。
Aardvark开发ARD-201的目的是解决当前GLP-1疗法的一些局限性,包括停药后体重反弹、胃肠道耐受性差和瘦体重下降。
此前TAS2R激动剂ARD-101的2a期临床试验数据显示,在两个不同的受试者人群中(一般肥胖受试者,以及减肥手术后出现难治性体重增加的受试者),ARD-101降低了饮食控制问卷(CoEQ)评估的饥饿等级。这为ARD-201的治疗潜力提供了见解,因为联合用药在临床前环境中比单药(ARD-101)显示出更强的效果。
Aardvark计划启动一项2期多臂临床试验,称为EMPOWER研究(Exploratory Multi-arm Prevention Of WEight Regain),以探索ARD-201在肥胖和肥胖相关疾病中的潜在临床应用,以及它如何作为当前GLP-1疗法的补充。
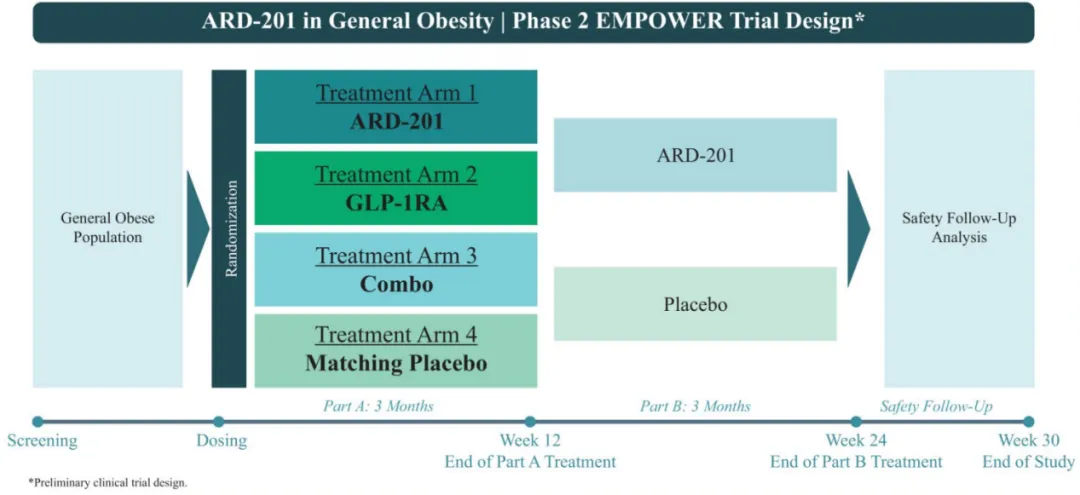
鉴于当前减肥药物市场竞争十分激烈,Aardvark打算与FDA进行讨论,计划跳过ARD-201在肥胖和肥胖相关疾病中的早期临床试验,直接开启2期EMPOWER研究。Aardvark预计,经监管部门批准,将于2025年下半年启动这项试验,预计2026年上半年获得顶线数据。
除了上述两款主要候选产品,Aardvark还在开发其他项目,用于治疗具有未满足需求的潜在适应症,包括TAS2R信号介导的其他疾病。Aardvark还在开发一个与TAS2R无关的临床项目,这是一种用于治疗自闭症的低剂量纳曲酮液体缓释制剂。
据摩熵医药数据提供线索,Aardvark曾在2021年3月将ARD-301(一种低剂量纳曲酮缓释制剂)用于治疗慢性疼痛、纤维肌痛和COVID-19后遗症的独家许可授予非阿片疼痛药物公司Scilex Holdings。据了解Scilex Holdings曾是Sorrento Therapeutics的子公司,而Sorrento曾牵头Aardvark的B轮融资,不过Sorrento已在2023年申请破产。

图源:摩熵医药数据
财务状况
自2017年成立以来,Aardvark已经在一级市场筹集了1.291亿美元资金。IPO前最近的一次融资是在2024年5月,Aardvark完成了由德诚资本牵头的8500万美元的C轮融资,作为投资的一部分,德诚资本的董事总经理Victor Tong加入了Aardvark的董事会。
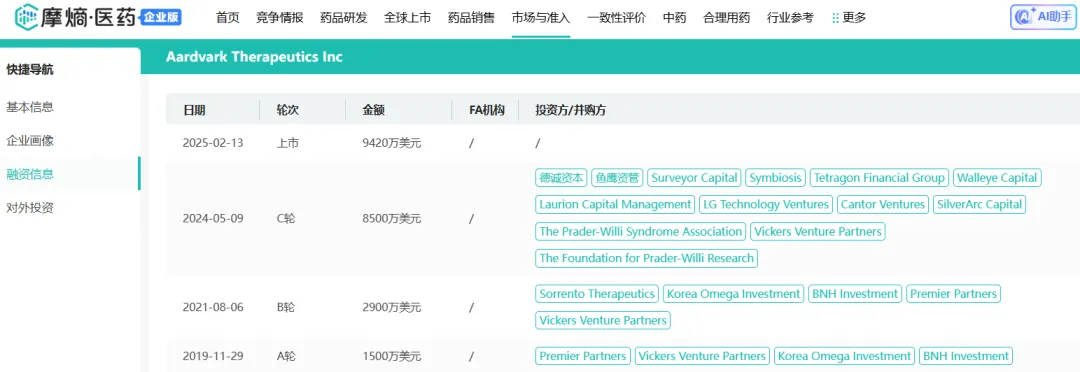
Aardvark融资历程 图源:摩熵医药数据
以下为Aardvark公司IPO前后股东持股情况:大股东包括德诚资本、伟高达、公司CEO Tien-Li Lee博士及其配偶Jane Wu Lee博士,以及伟高达联合创始人Jeffrey Chi(季淳钧)博士。

2024年前三季度,Aardvark运营支出1334万美元,其中研发支出930万美元,一般和行政支出392万美元,前三季度净亏损1181万美元。
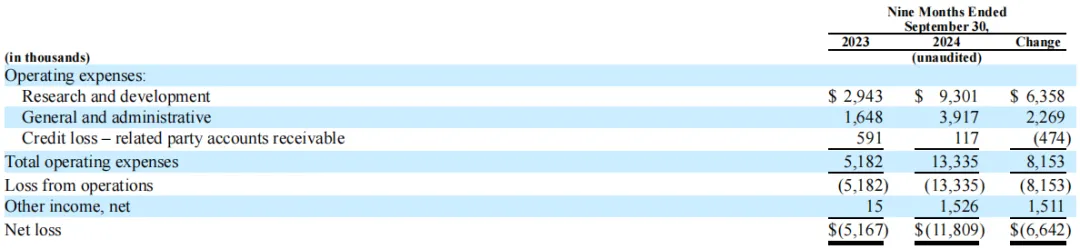
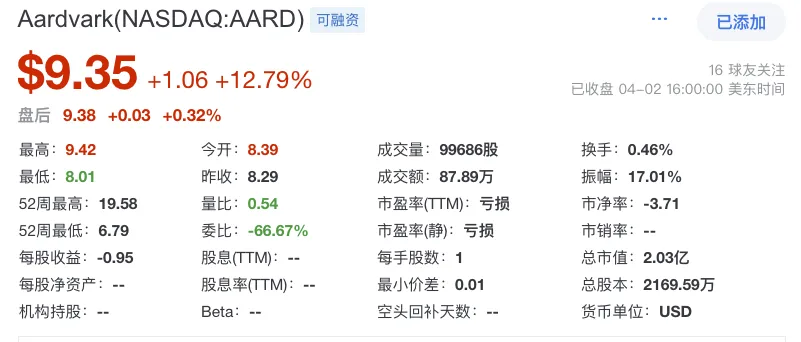
截至2024年12月31日,Aardvark拥有约7370万美元的现金、现金等价物和短期投资。截至2025年2月25日收盘该公司总市值2.92亿美元。截止今天发稿前,市值为2.03亿美元。
结语
Aardvark试图以“苦味受体”在GLP-1统治的减重市场撕开一道裂缝。其罕见病布局可短期避战巨头,但长期或许仍需在普通肥胖领域证明价值。若后续临床数据积极,则有望成为资本市场的“黑马”,甚至引发大药企并购。然而,创新靶点的风险与回报始终并存——究竟是颠覆者,还是“无人区”的探路炮灰?我们拭目以待。
Aardvark意为土豚,这种动物饭量很大,一夜可以吃掉50000只白蚁。

图源:Encyclopædia Britannica

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 14
14

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 13
13

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 14
14