 研发追踪
研发追踪
 新药猎人笔记
新药猎人笔记  2025-04-07
2025-04-07
 1484
1484

2025年3月31日,大冢制药(Otsuka Pharmaceutical)宣布已向美国食品药品监督管理局(FDA)提交了Sibeprenlimab的生物制品许可申请(BLA),用于治疗成人免疫球蛋白A肾病(IgAN)。
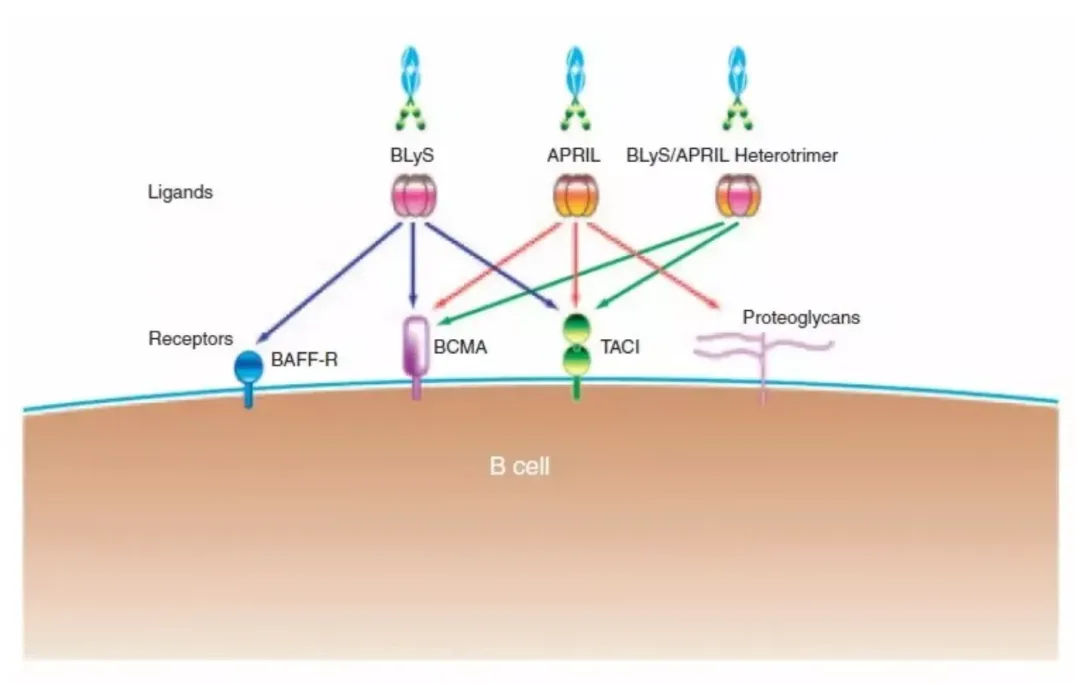
Sibeprenlimab是一种新型单克隆抗体,能够选择性抑制增殖诱导配体(APRIL)的活性,从而减少致病性半乳糖缺陷型IgA1(Gd-IgA1)的产生。
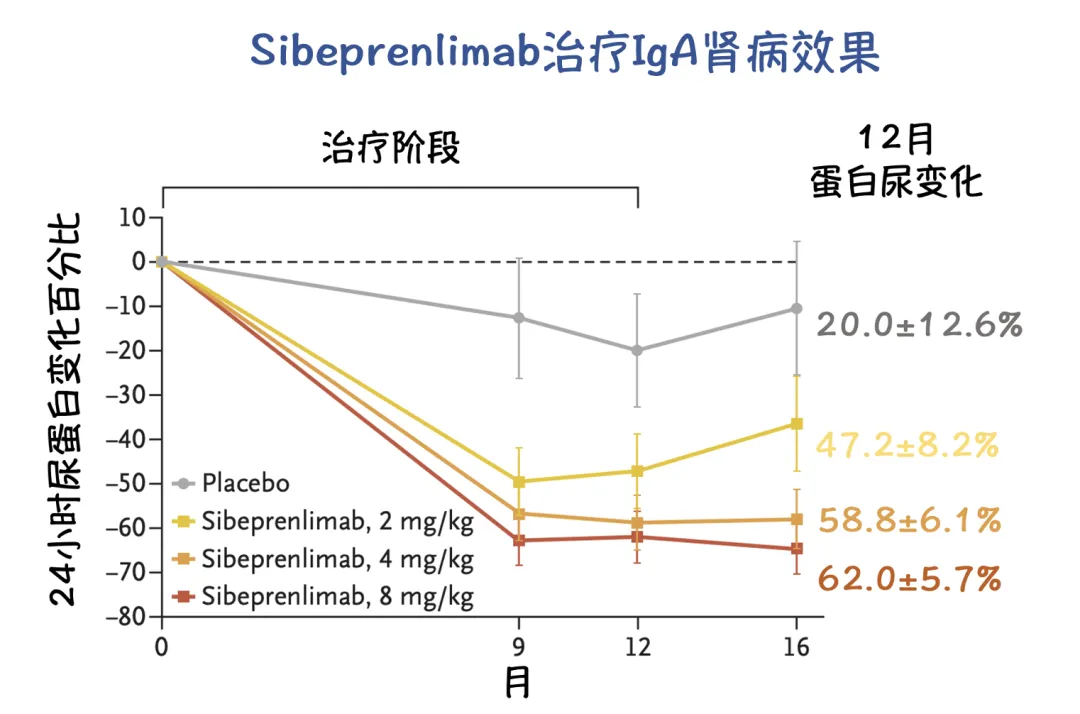
根据临床二期 ENVISION临床试验:在第12个月时,与基线相比,接受2、4和8 mg/kg剂量的sibeprenlimab各组患者24小时尿蛋白/肌酐比值(UPCR)的几何平均比值降幅分别为47.2%、58.8%和62.0%,安慰剂组为20.0%。
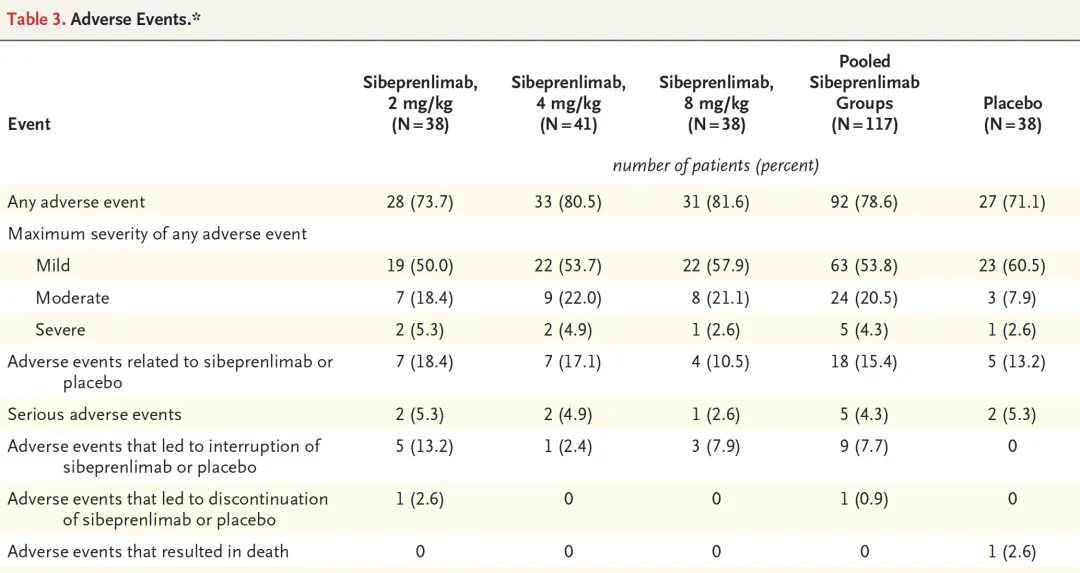
患者在临床试验过程中对新药的耐受性较好,Sibeprenlimab组没有严重不良事件发生,大多数不良事件为轻中度。
和竞品的对比
2024年11月,Vertex在美国肾脏病学会肾脏周大会上公布了Povetacicept在IgA肾病(IgAN)、原发性膜性肾病(pMN)的最新数据。在54例每四周皮下注射给药Povetacicept的 80mg或240 mg IgA肾病患者中,接受Povetacicept 80mg治疗的IgA肾病患者,第48周时尿蛋白平均减少66%,平均尿蛋白肌酐比(UPCR)从基线的1.3g/g降至0.5g/g。
云顶新耀引进的耐赋康(已获批)在48周的时候,下降49.7%。
英文链接:
https://www.otsuka.co.jp/en/company/newsreleases/2025/20250331_1.html

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 58
58

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 52
52

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 50
50