 研发追踪
研发追踪
 细胞与基因治疗领域
细胞与基因治疗领域  2025-04-14
2025-04-14
 2120
2120
近日,Cartesian Therapeutics 公布了其 mRNA CAR-T 细胞疗法 Descartes-08 在慢性自身免疫性疾病全身型重症肌无力(MG)患者中的 IIb 期临床试验 12 个月随访数据。数据显示,接受单次 6 周疗程治疗的患者在 12 个月评估时仍持续表现出症状改善。 该公司将于今年第二季度启动该 III 期试验 AURORA 首例患者给药。
Descartes-08 是 Cartesian Therapeutics 研发的一种潜在「first-in-class」自体 mRNA CAR-T 疗法。它通过靶向 B 细胞成熟抗原(BCMA),清除分泌自身抗体的浆细胞。
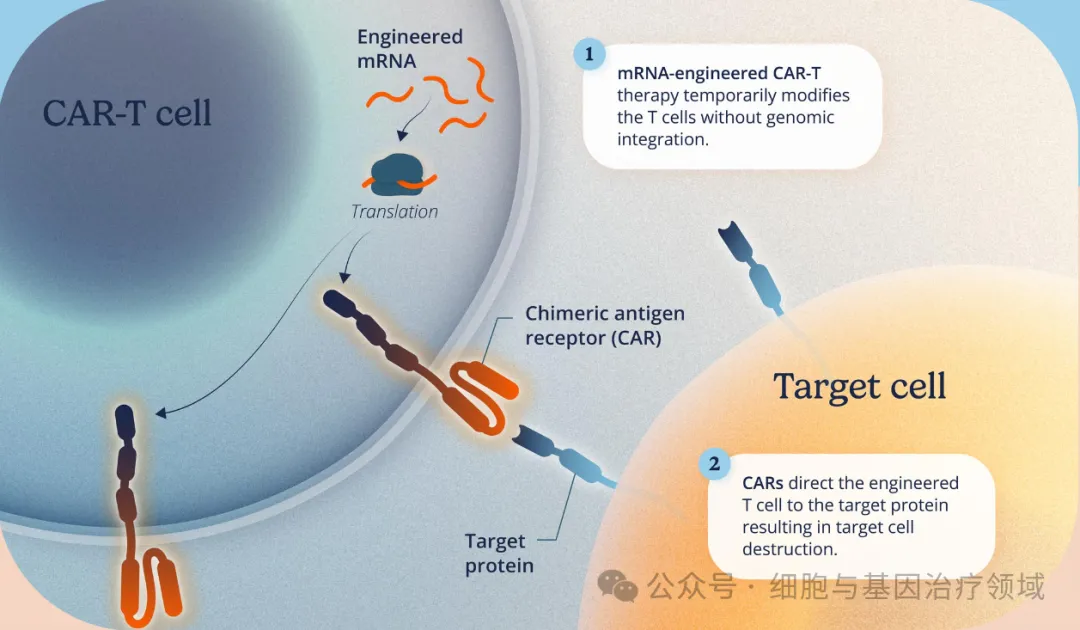
与传统的基于 DNA 的 CAR-T
细胞疗法相比,mRNA CAR-T
细胞疗法的给药设计不需要预处理化疗,而且据观察具有可预测和可控制的药代动力学,可以进行门诊给药,并避免了基因整合和癌症转化的风险。
在 IIb 期双盲、安慰剂对照、交叉试验中,共有 36 名症状严重、经过大量治疗的 MG 患者被随机分配(1:1)接受每周一次门诊输注 Descartes-08 或安慰剂治疗共 6 周,患者不进行预处理化疗。
如先前公告所述,该试验达到了其主要终点,并证明了 Descartes-08 支持门诊给药的安全性特征。
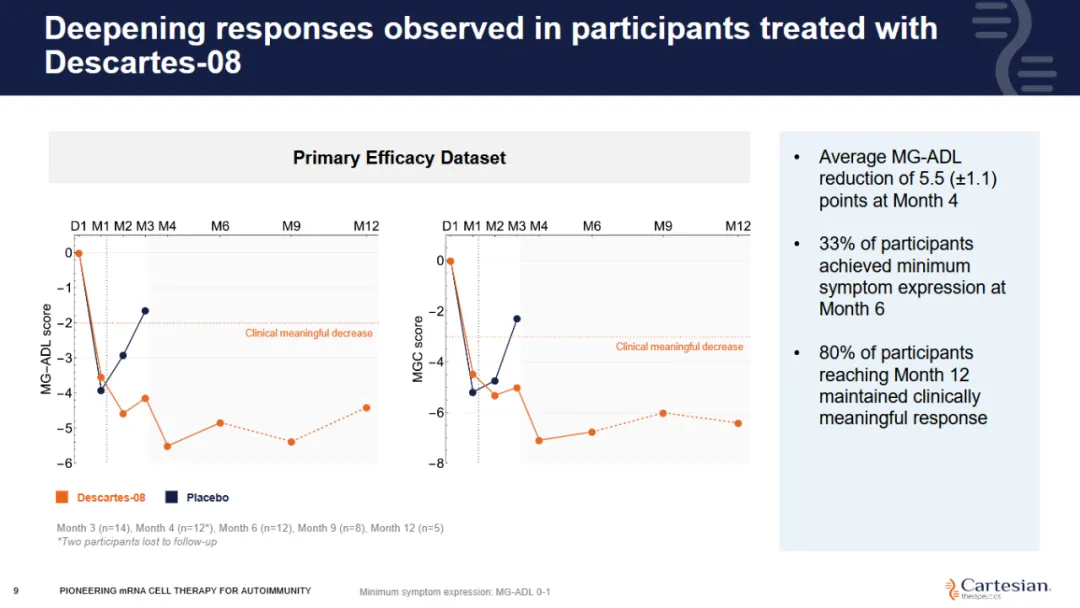
▲ Descartes-08 的主要疗效结果
该 IIb 期临床试验随访部分的主要疗效数据集由所有在学术医疗中心入组并接受至少一剂 Descartes-08 且完成至少一次第 3 个月后 MG 日常生活活动量表(MG-ADL)评分随访评估的受试者组成的修改意向治疗(mITT)人群组成。
截至 2025 年 3 月 31 日,在 12 例可评估的全身型 MG 患者中,33% (4 例) 在接受 Descartes-08 治疗 6 个月后,达到最小症状表达(MSE)标准,并维持至 12 个月。83%(10/12)患者维持临床意义应答达 12 个月,即 MG-ADL 评分持续降低≥2 分。
更为显著的是,在 7 例未接受过标准生物制剂治疗的患者亚组中观察到了「最显著且最具说服力的持续应答」:近 60% 达到并维持 MSE 状态达 12 个月,且该亚组所有患者均保持临床意义应答。
Descartes-08 安全性良好,在 12 个月随访期间,未报告细胞因子释放综合征或免疫效应细胞相关神经毒性综合征。
鉴于上述数据,Cartesian Therapeutics 计划于第二季度启动 III 期 AURORA 试验,该研究采用与 FDA 达成的特殊方案评估 (SPA) 框架。值得一提的是,Descartes-08 此前已获得美国 FDA 授予再生医学先进疗法 (RMAT)认定和孤儿药资格认定,用于治疗 MG。
英文链接:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 53
53

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 49
49

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 46
46