 产业资讯
产业资讯
 药时空
药时空  2025-04-18
2025-04-18
 2059
2059
近日,重组人血白蛋白领域有两则重磅新闻:一是安睿特重组人白蛋白注射液Ⅲ期临床试验完成揭盲,二是央视新闻一则“稻米造血”报道引起了广泛关注。
01 重组人血白蛋白III期临床相继取得成功
2025年4月16日,通化安睿特发布消息称,公司自主研发的重组人白蛋白注射液国内Ⅲ期临床研究完成揭盲,取得了良好的数据,其中包括完全符合国家要求的临床疗效指标和安全性数据。
安睿特通过基因重组技术生产的重组人白蛋白,利用先进的酵母表达系统,实现了高纯度、高稳定性的超大规模生产,不仅规避了血浆来源限制,还显著降低了病毒污染风险,其分子结构与天然人血白蛋白高度一致。
此次Ⅲ期临床研究采取多中心、随机、双盲、阳性药物对照设计,以治疗后血清ALB的变化为主要终点指标,比较重组人白蛋白(rHA)与人血白蛋白(HSA)注射液在肝硬化腹水患者低白蛋白血症中的疗效等效性,以腹水深度改善率作为关键次要指标比较非劣效性。
初步结果显示:重组人白蛋白注射液治疗肝硬化腹水患者低白蛋白血症具有良好的疗效,与人血白蛋白疗效相当,起效速度相近且疗效维持时间更具优势,安全性和耐受性良好。详细结果将于近期公布。
此前,通化安睿特的重组人白蛋白注射液已于2024年4月正式获得欧亚经济联盟—俄罗斯联邦卫生部批准上市,成为全球唯一上市销售的重组人白蛋白注射液产品,填补了全球生物医药产业的空白。
除俄罗斯外,安睿特也与土耳其、乌兹别克斯坦等“一带一路”的多个国家达成了合作,同时与奥地利、墨西哥、阿尔及利亚、印度尼西亚等国家建立了广泛的伙伴关系,并计划在美国进行FDA快速临床申请。
近期,通化安睿特的重组人白蛋白注射液还获得吉尔吉斯斯坦国家药品和医疗器械监督管理局颁发的MAH许可,这是继俄罗斯之后安睿特在海外获得的第二个MAH许可证;公司还与沙特阿拉伯Elaj Group签署了框架合作备忘录;与埃及医疗保健局就相关合作事宜正在进行探讨等。
除通化安睿特外,禾元生物也在重组人血白蛋白的研发方面取得了重大进展。
2024年11月底,禾元生物向全球公开发布了一项重大研究成果:其自主研发的重组人血清白蛋白注射液(奥福民,HY1001),在确证性临床研究中成功达到研究终点。
禾元生物运用基因编辑技术,将人血清白蛋白基因精确植入水稻基因组,成功表达人血清白蛋白。数据显示,改造后的基因工程水稻,1公斤稻米产出约10克血清白蛋白,远超传统血浆提取技术的生产效率。因此,其又被称为“稻米造血”。
奥福民已于2024年8月被国家药品监督管理局纳入优先审评品种名单,并于9月12日获得新药上市申请受理。据悉目前,禾元生物年产100万支奥福民的“黑灯工厂”已启动投产并获得《药品生产许可证》;年产120吨(1200万支)奥福民的“灯塔工厂”正在建设,预计2026年建成并投产。
02 国内重组人血白蛋白在研情况
白蛋白是人血浆中最丰富的蛋白质,占血浆总蛋白含量的50-60%,其最重要的生理功能包括维持渗透压、保持毛细血管通透性、稳定内皮细胞、转运和代谢多种化合物等,临床上主要用于补充体液和治疗低蛋白血症等。
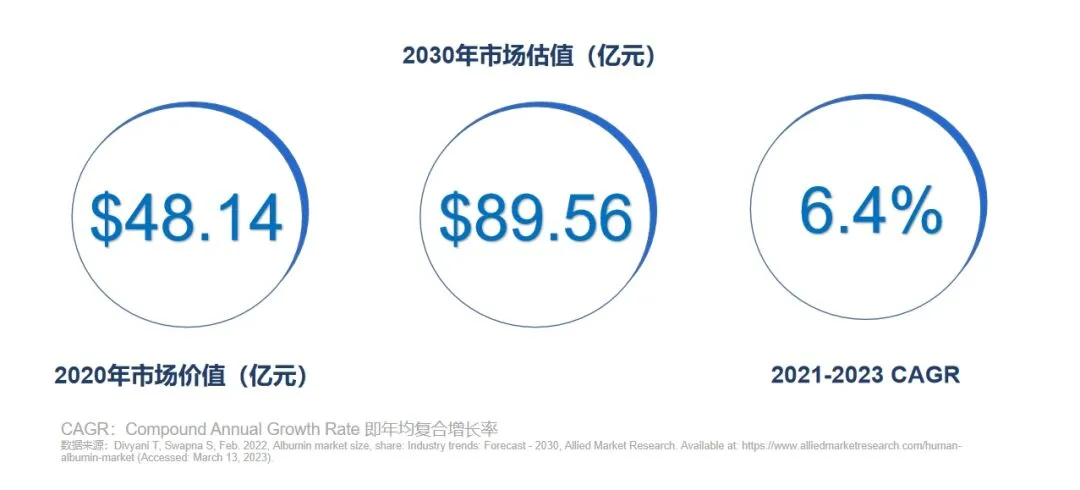
据安信证券数据披露,国内白蛋白的理论年总需求量约为1500-1800吨,但2021年全国批签发量为658吨,市场渗透率约为37%-44%。从全球层面来看,Allied Market Research数据预估,2020年全球人血清白蛋白治疗药物市场规模达到48.14亿美元,2030年预计达到89.56亿美元,复合年均增长率达到6.4%。全球人血白蛋白用量仍有发展空间,且亚太地区的复合年增长率预计会高于全球平均水平达到7.7%,但是供需矛盾一直是我国人血清白蛋白市场长期面临的问题。
由于人血白蛋白需求量属于血液制品中最大的产品,仅靠国内产能生产无法满足患者用量,人血白蛋白也是唯一一个允许进口的血液制品,且主要依赖进口产品。而重组人血白蛋白(rHSA)是人血白蛋白的替代产品,研发目的之一是为了补足人血白蛋白市场空缺,期望可以达到国产人血白蛋白自给自足的状态。
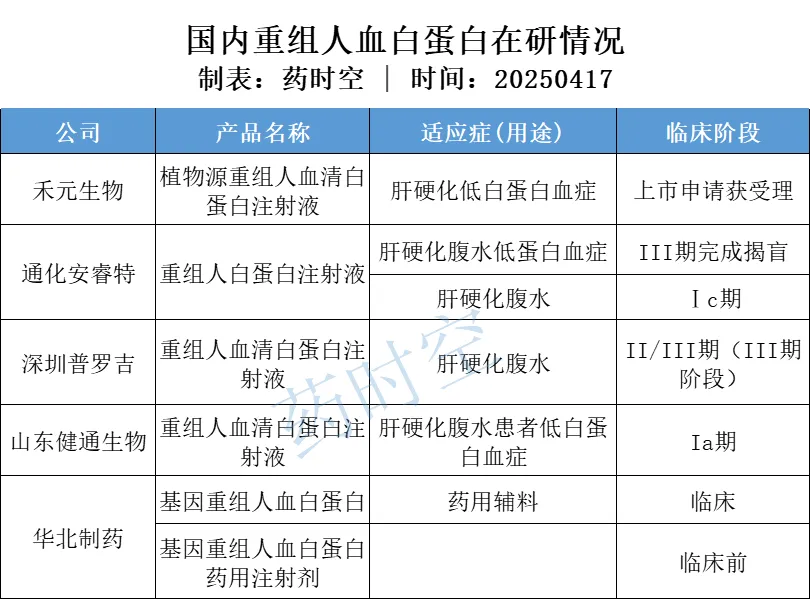
关于rHSA,国内外开展相关研究已数十年,但目前仍未出现在全球大范围内上市的成熟产品。至于国内,目前尚无重组人血白蛋白产品上市,现已知进展最快,有望在国内上市的产品就是上述提到的禾元生物和通化安睿特的重组人血白蛋白产品。
其他国内在研企业还包括:
深圳普罗吉医药:重组人血清白蛋白注射液处于Ⅲ期临床阶段,进行中但尚未开始招募,适应症为肝硬化腹水。
健通生物:重组人血清白蛋白注射液处于Ia期临床,目标入组人数48人,目前已入组12人,适应症为肝硬化腹水患者低白蛋白血症。
华北制药:辅料级重组人血白蛋白已获得国家食品药品监督管理局药品生产许可证。据华北制药举办的2024年半年报集体业绩说明会显示,基因重组人血白蛋白作为药用辅料用途已进入临床试验阶段,基因重组人血白蛋白药用注射剂正在进行临床前研究。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 21
21

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 33
33

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 23
23