 研发追踪
研发追踪
 药明康德
药明康德  2025-04-21
2025-04-21
 1547
1547
突破性疗法再次递交监管申请

ImmunityBio公司日前宣布,已在2024年第一季度,向FDA提交Anktiva(nogapendekin alfa
inbakicept)联合卡介苗(BCG)的补充生物制品许可申请(sBLA),用于治疗BCG无应答、具有乳头状病变的非肌层浸润性膀胱癌(NMIBC)患者。若获得批准,该药物将使更多患者受益,从而帮助更多患者避免与根治性膀胱切除术相关的高发病率与死亡率。
Anktiva是一款白细胞介素-15(IL-15)超级激动剂。该疗法在2019年获FDA授予突破性疗法认定,用于与BCG联合治疗此前对BCG应答不佳的非肌层浸润性原位膀胱癌患者。2024年4月,美国FDA批准Anktiva与BCG联合使用,用于治疗对BCG无应答且伴有原位癌(CIS)的NMIBC成年患者,这些患者伴或不伴有乳头状肿瘤。值得一提的是,行业媒体Evaluate曾将这款疗法列为2024年有望获批的10款潜在重磅疗法之一。
这次提交给FDA的数据显示,接受Anktiva联合BCG治疗的患者中,有88%在治疗后两年内避免了膀胱切除,82%在三年内仍未需手术切除膀胱。由于根治性全膀胱切除术相关的死亡率和发病率较高,这一具有长效膀胱保留潜力的治疗方案有望为BCG无应答、具乳头状病变的患者带来显著的临床获益与生活质量改善。
癌症疫苗联合疗法2期试验积极结果公布
日前,BriaCell Therapeutics公司宣布,其在研癌症疫苗疗法Bria-IMT联合免疫检查点抑制剂(CPI)在2期临床研究中取得了积极生存期数据,在激素受体阳性(HR+)转移性乳腺癌(MBC)患者中显示出优于现有抗体药物偶联物药物(ADC)的疗效。

在该公司针对晚期转移性乳腺癌的2期临床试验中,共有37名患者接受Bria-IMT治疗,其中25名被确认为HR+乳腺癌患者。分析显示,这25名患者的中位总生存期(17.3个月)优于当前ADC标准治疗Trodelvy(14.4个月)。在三阴性乳腺癌(TNBC)患者中,Bria-IMT联合免疫检查点抑制剂治疗方案的生存数据则与Trodelvy相当,但依然显著优于化疗治疗组,生存率提高约70%。截至目前,尚未报告因Bria-IMT导致的治疗中断事件。
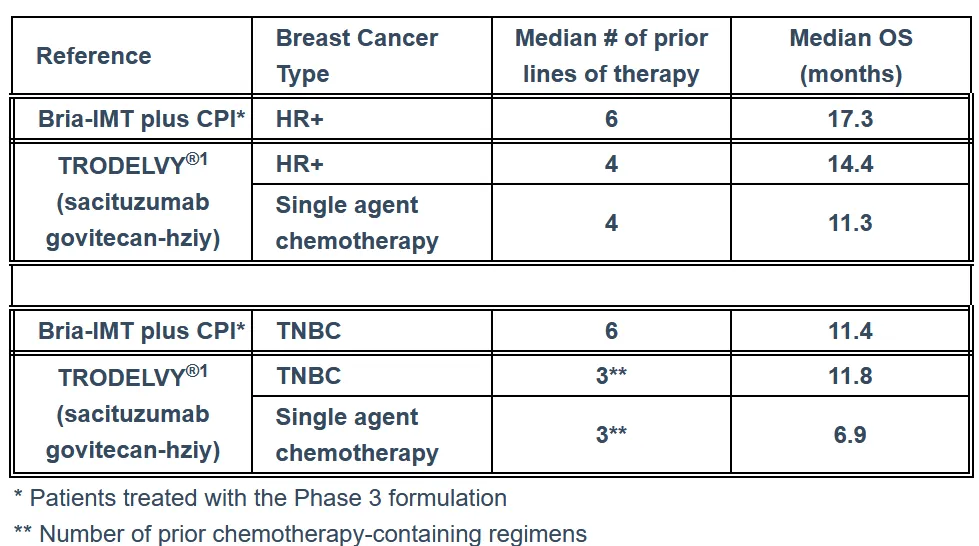
▲Bria-IMT临床2期试验结果摘要(图片来源:参考资料[2])
出处:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 53
53

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 49
49

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 46
46