 产业资讯
产业资讯
 药融圈
药融圈  2025-04-22
2025-04-22
 496
496
全球传染病的防控形势严峻,疫苗作为预防传染病的有效手段,其研发与创新至关重要。Dynavax Technologies成立于1996年,最初名为Double Helix Corporation,1999年更名为Dynavax Technologies,是一家处于商业阶段的生物制药公司,致力于开发和商业化新型疫苗,利用创新佐剂技术,助力全球抵御传染病威胁。从摩熵医药数据库获悉,Dynavax Technologies在2018年进行了未公开轮次的融资,金额为1.75亿美元;2024年宣布了一项2亿美元的股票回购计划,其中1亿美元通过加速股票回购计划完成,并计划在2025年完成剩余的1亿美元回购。
药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据 企业信息
为加速产品研发与市场拓展,Dynavax Technologies积极开展合作与授权。在研发端,与阿斯利康、GSK等大型药企合作开发新疫苗产品,借助合作伙伴的研发资源、技术优势以及临床研究能力,提升研发效率,降低研发风险。在市场推广方面,通过授权合作,将产品在特定区域的营销和分销权授予当地有实力的企业,如Bavarian Nordic在德国对HEPLISAV-B的推广,利用其本土市场渠道和营销经验,快速提升产品知名度和市场占有率,实现互利共赢。
01HEPLISAV-B:市场增长的强劲引擎
HEPLISAV-B是Dynavax Technologies的第一款商业产品,已获得FDA和欧盟委员会的批准,用于预防18岁及以上成人由所有已知乙型肝炎病毒亚型引起的感染,只需在一个月内接种两剂即可完成系列接种。该疫苗采用创新的CpG1018佐剂技术(公司专有的TLR9激动剂佐剂,下文会详细介绍),显著提高了免疫反应的强度和持久性,保护率高达95%,显著优于传统乙肝疫苗。除了HEPLISAV-B,美国还有其他四种疫苗被批准用于预防乙型肝炎,分别是来自GSK的Engerix-B和Twinrix、默克的Recombivax-HB和VBI Vaccines的PreHevbrio。

另外Dynavax
Technologies还在继续探索增强HEPLISAV-B临床特征的方法,公司完成了一项开放标签、单臂研究,该研究在4剂HEPLISAV-B方案中用于正在开始或正在接受血液透析的终末期肾病成人患者。最终免疫原性结果包括89.3%的血清保护率和高水平抗HBs抗体;安全性数据显示HEPLISAV-B耐受性良好,未观察到安全问题;在成人血液透析中的安全性和有效性尚未确定。向FDA提交了HEPLISAV-B疫苗接种的sBLA,2024年第四季度,公司收到了FDA的反馈,内容涉及开展观察性回顾性队列研究的可能性,以支持针对成人血液透析的sBLA申报。预计在2025年向FDA重新提交用于成人血液透析HEPLISAV-B疫苗接种的sBLA。
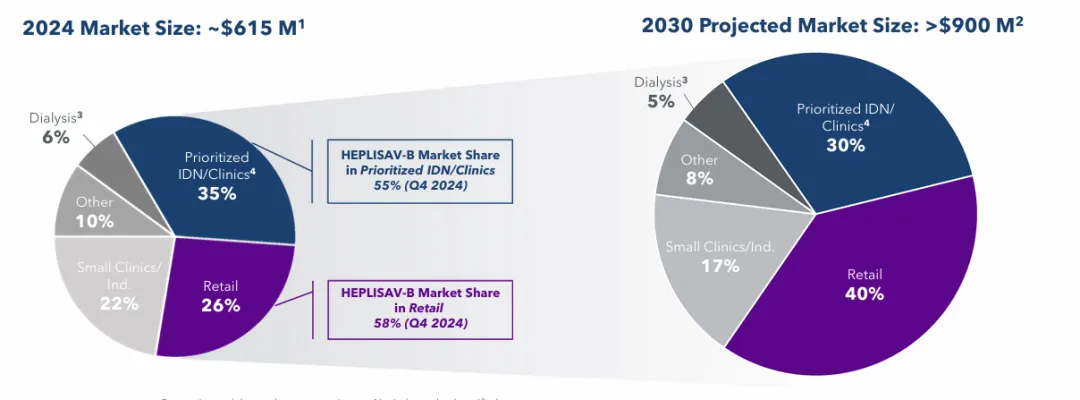
2024年,HEPLISAV-B的净产品收入为2.68亿美元,与2023年的2.13亿美元同期相比增长26%,成为公司收入增长的主要驱动力。预计到2030年,HEPLISAV-B在美国的市场将增长到9亿美元的峰值,届时总市场份额会从2024年的44%增加到60%,主要由零售药房细分市场的扩张推动市场机会增长。
02TLR激动剂佐剂:
精准激活免疫系统的新钥匙
Dynavax Technologies的核心技术依托Toll样受体(TLR)激动剂佐剂。TLR是一个跨膜蛋白家族,在先天免疫和适应性免疫中起着至关重要的作用,通过这些受体的信号转导是由多种病原体相关分子的结合触发的,对于先天免疫的产生至关重要。疫苗产品中用于刺激增强免疫反应的化合物通常称为佐剂。
以公司专有的TLR9激动剂佐剂CpG 1018为例,它能够靶向仅在少数关键细胞类型上表达的单一明确受体TLR9,当CpG 1018与疫苗联合使用时,可刺激机体免疫系统。临床前和临床研究表明,添加CpG 1018佐剂能增加抗体浓度,刺激辅助(CD4+)和细胞毒性(CD8+)T细胞群,并产生强大的T和B细胞记忆反应。同时,强烈有利于辅助T细胞Th1子集的发育,Th1细胞对于防止病毒和细胞内细菌感染至关重要。这种独特的作用机制,为增强疫苗免疫原性提供了新途径。
与传统佐剂相比,TLR激动剂佐剂具有显著优势。传统佐剂在提升免疫反应强度与持久性方面存在一定局限。而TLR激动剂佐剂可精准激活免疫系统特定通路,增强免疫反应的针对性和有效性。在HEPLISAV-B中,正是由于CpG
1018佐剂的应用,使得该疫苗在免疫效果上优于部分传统乙肝疫苗。如在一些临床试验中,接种HEPLISAV-B的受试者产生抗体的速度更快、浓度更高,且免疫记忆维持时间更久,体现了TLR技术平台在疫苗研发中的强大潜力。
03疫苗研发的前沿探索
Dynavax Technologies正在利用专有的疫苗佐剂技术,构建创新的研究性候选疫苗产品管线。
1、"双剑客"联破免疫困局:第二代带状疱疹疫苗冲刺精准防护新纪元
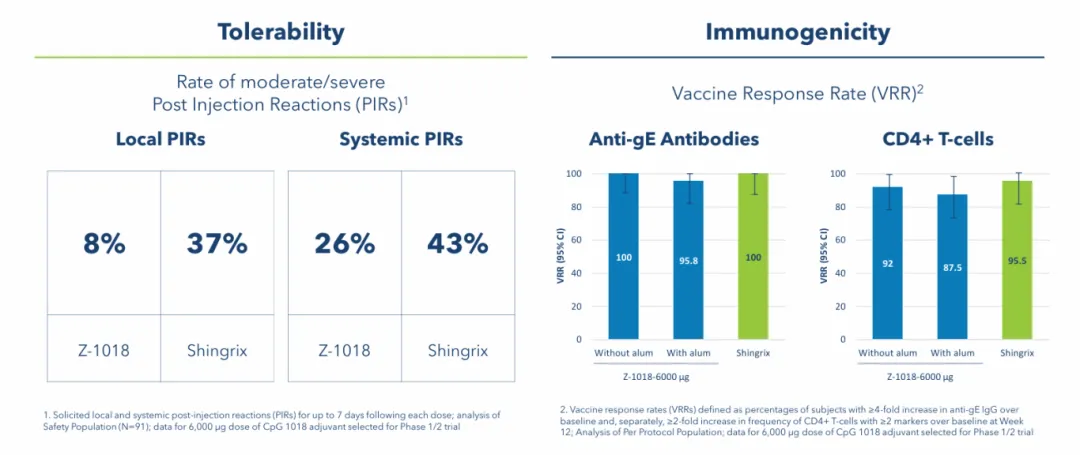
带状疱疹是潜伏性水痘-带状疱疹病毒(VZV)感染再激活的极其痛苦的后果,发作会导致包括慢性疼痛在内的潜在并发症。2022年1月,Dynavax Technologies启动了带状疱疹候选疫苗的临床试验1期研究,该研究旨在评估由糖蛋白E(gE)和CpG 1018佐剂组成的候选疫苗的安全性、耐受性和免疫原性。在2剂方案后4周,Z-1018在所有组中均显示出高抗体和CD4+ T细胞疫苗反应率,这与获得许可的对照剂相似,且Z-1018组引发的全身不良事件和局部注射后反应以及中度和重度反应的总频率相似,低于对照组。
2024年6月,公司启动了Z-1018的临床试验1/2期研究,旨在评估其安全性、耐受性和免疫原性。该研究入组于2024年完成,在澳大利亚试验地点招募了大约440名年龄在50~69岁之间的健康成年人,该验的主要目标包括选择最佳的gE蛋白剂量水平和给药方案,以便进一步进行临床开发。另外,临床试验1/2期研究将用于支持患者报告结果测量工具的验证,以区分Z-1018的耐受性并支持潜在的标签声明,预计2025年第三季度报告免疫原性和安全性数据。
2、生物防御闪电战:CpG 1018佐剂点燃鼠疫疫苗迭代引擎
2021年9月,Dynavax Technologies与美国国防部达成协议,在两年半内开发一种含CpG 1018佐剂的重组鼠疫疫苗。根据协议,公司会进行一项临床试验2期研究,将CpG 1018佐剂与国防部的rF1V疫苗相结合,表明一个月内接种两剂CpG 1018佐剂疫苗与在六个月内接种三剂铝佐剂疫苗相似。
2023年1月,评估CpG 1018辅助治疗鼠疫(rF1V)候选疫苗成人免疫原性、安全性和耐受性的临床试验2期研究的第1部分成功完成。两个CpG 1018佐剂组均达到第1部分的主要终点,并且在两剂后抗体含量比明矾佐剂对照组增加两倍以上。2023年完成了临床试验2期研究第2部分的入组和给药,2024年底,完成了临床试验2期研究,根据该研究的结果,又与美国国防部签署了一项新协议,到2027年上半年国防部将提供约3000万美元,以支持额外的临床试验2期研究和生产活动,预计在2025年第三季度启动额外的临床试验2期研究。
3、战略止损的艺术:Tdap-1018数据迷雾背后的技术进化论
2024年11月,Dynavax Technologies停止了Tdap-1018的开发,主要是因为该项目没有表现出可能会在商业上取得成功的差异化特征。该项目是公司2017年6月与Serum Institute of India(SIIPL)达成的协议,双方共同合作开发和商业化某些潜在疫苗,包括含CpG 1018佐剂的Tdap加强针。根据协议,Dynavax Technologies拥有疫苗商业化的全球独家权利,SIIPL拥有在印度分销和履行联合国儿童基金会招标合同的独家权利,各方负责各自地区的临床开发成本。
2023年12月,在接种Tdap-1018的非人灵长类动物中,感染后具有预防疾病保护和强大的Th1细胞反应。在收到FDA关于Tdap-1018临床开发计划的B型会议反馈后,通过对完成Tdap-1018加强剂量的1期试验的参与者进行长期随访研究,评估了Tdap-1018的免疫原性与活性对照相比。根据这项长期随访研究的结果,停止了该项目。
04扭亏为盈年
2024年度,Dynavax Technologies总收入2.77亿美元,除了HEPLISAV-B产品收入外,还有与美国国防部达成的协议的收入,该年度与美国国防部的协议确认了860万美元的收入;研发费用为6155万美元,与上年同期相比增加了670万美元;一般、行政和管理费用为1.70亿美元,与上年同期相比增加了1740万美元。2024年全年净收入为2730万美元,或每股0.21美元(基本)和每股0.20美元(摊薄)。
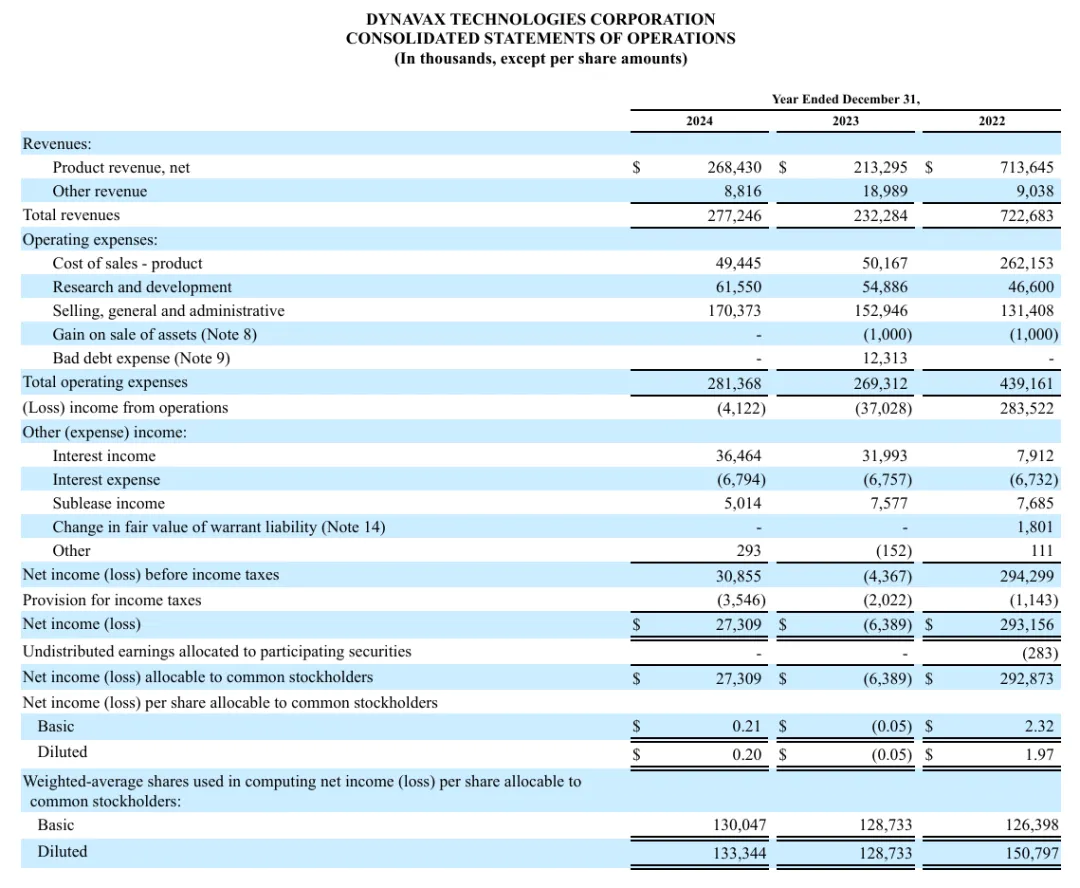
根据目前的运营计划,Dynavax
Technologies提供了2025年全年的财务指导:(1)HEPLISAV-B产品净收入预计在3.05~3.25亿美元;(2)调整后EBITDA预计为7500万美元。

截止2025年3月26日,Dynavax
Technologies公司总市值为16.85亿美元,约合人民币122亿元。截止发稿前市值为12.62亿美元。


 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 17
17

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 30
30

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 19
19