 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-04-23
2025-04-23
 1466
1466
4 月 22 日,CDE 官网显示,再鼎医药从 BMS 引进的瑞普替尼胶囊在国内申报一项新适应症 NDA。根据再鼎公开信息,本次申请适用于 NTRK 融合基因阳性实体瘤成人患者。这是再鼎今年以来递交的第 3 个新药上市(含新适应症)注册申请。
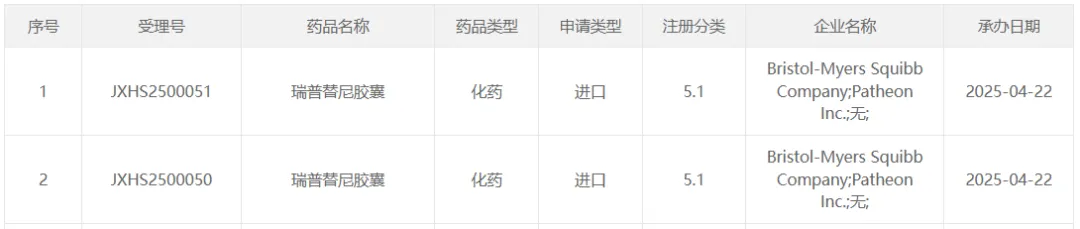
截图来源:CDE 官网
神经营养酪氨酸受体激酶(NTRK)是一类参与神经发育的受体。NTRK 基因融合是当含有 NTRK 基因的染色体片段断裂并与另一条染色体上的基因结合时发生的变异。这类融合导致异常蛋白质的产生,从而可能导致癌细胞生长。
瑞普替尼是新一代酪氨酸激酶抑制剂(TKI),靶向作用于 ROS1 和 NTRK 致癌因子。携带 ROS1 和 NTRK 基因融合的实体瘤(包括 NSCLC)患者在接受目前已获批准的靶向治疗后,通常会出现耐药突变,这些突变限制了药物与靶点的结合,最终导致肿瘤进展。作为新一代 ROS1 和 NTRK TKI,瑞普替尼的独特设计可用于改善包括脑部在内的获益持久性。
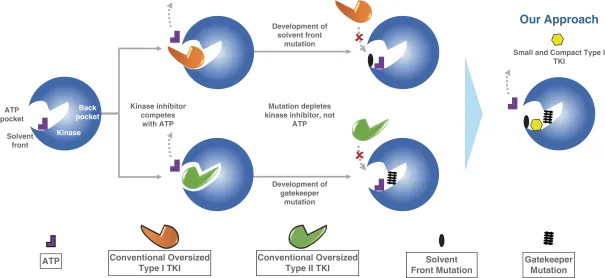
截图来源:Turning Point 招股书
2020 年 7 月,再鼎医药与 Turning Point(已被 BMS 收购)达成一项 1.76 亿美元的独家授权协议,获得瑞普替尼在大中华区(中国大陆、香港、澳门和台湾地区)的独家开发及商业化权。在海外,瑞普替尼已获 FDA 和欧洲 EMA 批准两项适应症:1)用于局部晚期或转移性 ROS1 阳性 NSCLC 成人患者的治疗;2)成人和 12 岁及以上儿童的 NTRK 阳性局部晚期或转移性实体瘤患者。
在国内,瑞普替尼于 2024 年 5 月首次获得 NMPA 批准上市,用于局部晚期或转移性 ROS1 阳性 NSCLC
成人患者。瑞普替尼本次提交的补充 NDA 适应症为 NTRK 阳性实体瘤,该适应症已在今年 2 月被 CDE 纳入优先审评。今年 3
月,这两项适应症已在中国台湾地区获批。

截图来源:CDE 官网
瑞普替尼 NTRK 阳性实体瘤适应症在美国的获批是基于 I/II 期 TRIDENT-1 研究的积极结果,该研究旨在评估瑞普替尼在 NTRK 阳性成人实体瘤患者中的疗效。该研究纳入了 40 名 TKI 初治和 48 名接受过 TKI 治疗的 NTRK 阳性实体瘤患者,其中涵盖了 15 种不同类型的癌症。研究的主要终点是 ORR。
研究结果显示:在 TKI 初治患者中,客观缓解率(cORR)为 58%,中位持续缓解时间(mDOR)尚未达到;在 TKI 经治的患者中,cORR 为 50%,mDOR 为 9.9 个月 。除了瑞普替尼,再鼎医药今年还有多款产品已在或者将在国内报上市,包括:
精神分裂症药物 KarXT(呫诺美林和曲司氯铵),这是再鼎从 Karuna 公司(已被 BMS 收购)引进的一种口服 M1/M4 型毒蕈碱乙酰胆碱受体激动剂和毒蕈碱受体拮抗剂的组合。该药于 24 年在美国获批,是 FDA 几十年来批准的首款具有全新作用机制的精神分裂症药物。今年 1 月,CDE 已受理 KarXT 用于治疗成人精神分裂症的 NDA,预测有望在明年 Q3 获批。
维替索妥尤单抗,再鼎从 Seagen(现已被辉瑞收购)引进的一款靶向组织因子(TF)的 ADC,是目前宫颈癌领域唯一一款获批的 ADC 疗法。今年 3 月,CDE 已受理该药用于治疗系统性治疗期间或之后病情进展的复发或转移性宫颈癌患者的上市申请。
贝玛妥珠单抗 ,这是再鼎从 Five Prime 公司(后被安进收购)引进的一款靶向 FGFR2b 的单抗,在海外和国内都处于 Ⅲ 期阶段,尚未获批。再鼎计划 2025 年上半年在国内提交贝玛妥珠单抗用于胃癌一线治疗的上市申请。
此外,再鼎今年还计划提交肿瘤电场治疗 (TTFields) 用于二线及以上 NSCLC 、胰腺癌一线治疗的上市申请。

 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 17
17

 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 29
29

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 19
19