 产业资讯
产业资讯
 医麦客
医麦客  2025-04-28
2025-04-28
 2056
2056
以PD-1/PD-L1,CTLA-4 等为靶点的免疫检查点抑制类抗体药物的出现彻底改变了肿瘤治疗的格局。然而,随着这类免疫抑制分子在临床研究的不断深入,在部分适应症上疗效渐显瓶颈,基于免疫刺激通路开发的新型肿瘤免疫治疗抗体药物应运而生。
T 细胞接合器(TCE) 作为新兴癌症免疫抗体疗法,通过在空间上拉近 T 细胞与靶细胞的距离,触发 T 细胞激活,实现高效肿瘤杀伤。其独特优势在于介导肿瘤细胞识别时不依赖主要组织相容性复合体(MHC),有效规避了肿瘤细胞通过下调 MHC I 类分子表达而逃逸免疫监视的难题。凭借高效性与灵活性,TCE 成为当前全球企业与科研机构的重点研发方向。
美国癌症研究协会(AACR)年会是肿瘤研究领域权威性与影响力兼备的顶尖学术盛会,每年发布的前沿成果堪称全球肿瘤行业发展的风向标与创新引擎。2025 年 AACR 年会于 4 月 25 - 30 日在美国芝加哥盛大召开,本文梳理入选大会摘要的代表性 TCE 管线,为行业从业者提供参考。
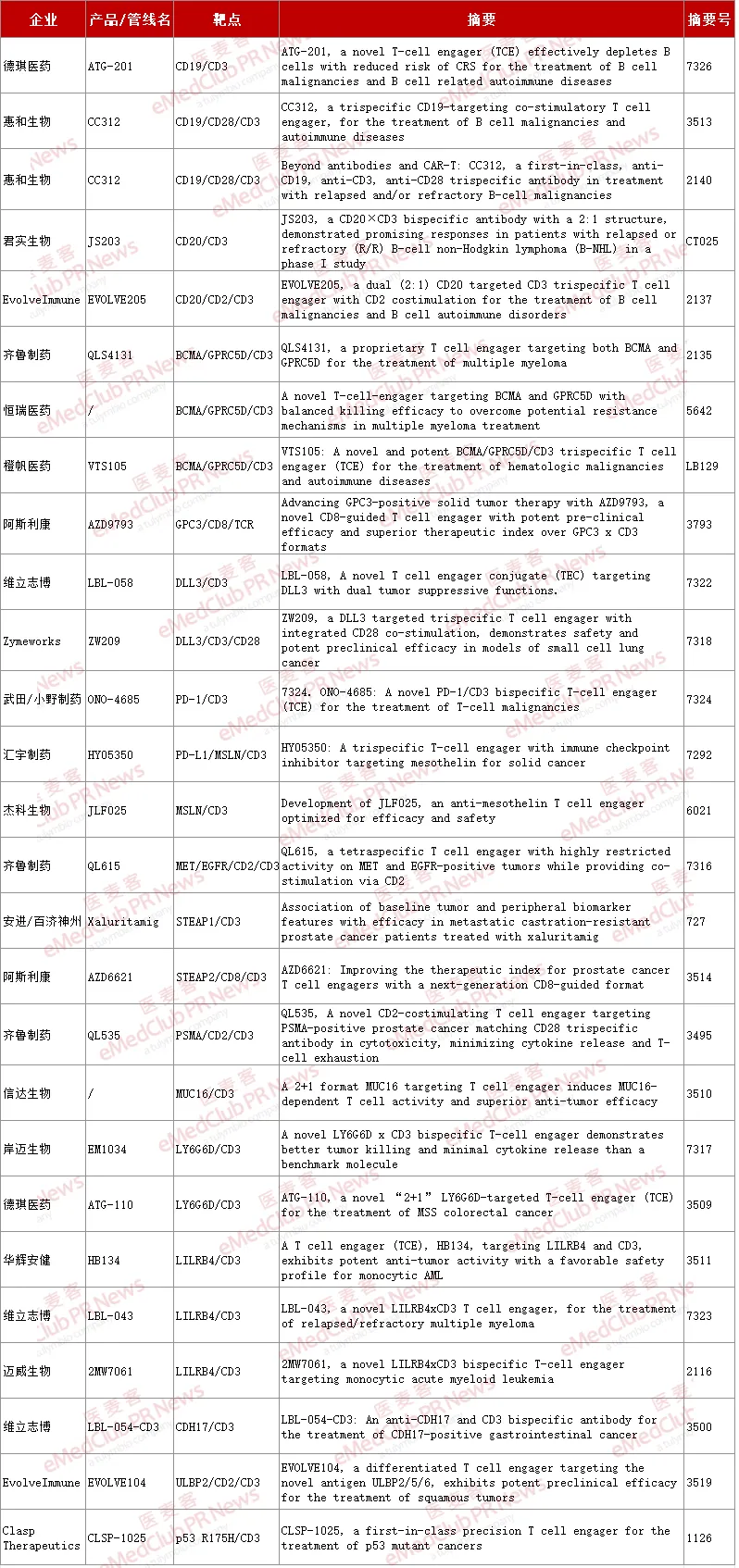
▲ 入选本次AACR企业的代表性TCE管线(以上排名不分先后)
据不完全统计,本次大会 TCE 赛道汇聚了安进、阿斯利康等跨国制药巨头(MNC),国内约 20 家生物医药公司更是成为亮眼主角,涵盖信达生物、恒瑞医药、齐鲁制药等。
在抗体类型上,从双特异性接合器、三特异性接合器到齐鲁制药创新开发的 MET/EGFR/CD2/CD3 四特异性接合器(QL615),技术迭代加速。
适应症上,实体瘤与血液瘤仍是研究焦点,部分企业也在积极探索自身免疫性疾病领域。
靶点选择则是 TCE 研发的核心关键。多数企业以 CD3 作为 T 细胞靶点,阿斯利康则另辟蹊径,采用 CD8 引导的 TCE 设计。除常见的 CD19、CD20、BCMA、GPC3、DLL 等肿瘤靶点,CDH17、LY6G6D、LILRB4、p53 R175 H 等新型靶点不断涌现,肿瘤与免疫检查点组合的靶向策略也成为新趋势。
以下为部分代表性企业管线详述:
惠和生物:CD19/CD28/CD3 三特异性 TCE,
开拓肿瘤与自免领域
CC312 是基于惠和生物新一代共刺激信号 TCE 平台 TriTETM 自主开发而来,主要针对肿瘤和自身免疫性疾病,亦是全球首个获批系统性红斑狼疮新药临床试验申请(IND)的 CD19/CD28/CD3 靶向三抗。
CC312 通过桥接 T 细胞和靶细胞,T 细胞在第一激活信号 CD3 和共刺激信号 CD28 双重作用下强烈、精准、持久地杀伤肿瘤,并通过有效清除 B 细胞发挥治疗自免疾病的作用。
一项研究者发起的临床试验,正评估 CC312 用于治疗难治性系统性红斑狼疮、特发性炎性肌病、系统性硬化症等 B 细胞相关自身免疫性疾病的安全性、耐受性及疗效。
目前数据显示,CC312 耐受性良好,未出现 3 级及以上细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)。即便在最低剂量(5 微克/剂)下,CC312 也可实现外周 B 细胞及其亚群的全面耗竭,且患者伴随疾病症状改善或缓解,展现出巨大的临床应用潜力 。
在针对复发/难治性 B 细胞非霍奇金淋巴瘤及复发/难治性淋巴细胞白血病患者开展的 Ia 期临床试验中,CC312 展现出良好的临床安全性。不同剂量的 CC312 均能实现外周血 B 细胞的多倍耗竭,并显著激发 B 细胞淋巴瘤患者体内 CD4 和 CD8 T 细胞的扩增与激活。
EvolveImmune :疗效更优的 CD20/CD2/CD3
靶向三特异性 TCE
EVOLVE205 是 EvolveImmune 开发的具有整合 CD2 激动作用的双靶点(2:1)CD20 靶向 TCE。该 TCE 通过 CD2 共刺激机制优化 T 细胞重定向,同时增强与 CD20 的亲和力,从而实现相较于临床基准的潜在优越性能。
在细胞水平上,EVOLVE205 在弥漫性大 B 细胞淋巴瘤细胞系模型及原发性组织 B 细胞中,均呈现出极强的细胞毒性。
尤为突出的是,在 B 细胞耗竭的外周血单个核细胞与 HT 肿瘤细胞的共培养实验中,相较于已上市的 CD20/CD3 TCE 药物格菲妥单抗(Glofitamab),EVOLVE205 的肿瘤杀伤效力提升高达 70 倍;与传统抗 CD20 单克隆抗体(如利妥昔单抗)相比,其杀伤能力更是增强超过 1000 倍。
动物研究表明,在格菲妥单抗的肿瘤生长允许给药剂量水平下,EVOLVE205 显示出显著增强的肿瘤生长抑制效果。
综合来看,EVOLVE205 在体外显示出强大的肿瘤杀伤能力,且不会诱导过多的细胞因子产生,还展现出显著的体内疗效以及良好的可开发性特征。
与临床上现有的用于治疗 B 细胞淋巴瘤和 B 细胞介导的自身免疫性疾病的靶向 CD20 的 TCE 和抗 CD20 单克隆抗体相比,整合了 CD2 共刺激功能的 EVOLVE205 具有更高的疗效和安全性优势。
阿斯利康:CD8 介导的靶向 GPC3/CD8/TCR
三特异性 TCE
AZD9793 是阿斯利康开发的一种创新型 CD8 引导的三特异性 TCE,目前正在开发用于治疗 GPC3 阳性的实体瘤,包括肝细胞癌(HCC)。
它由两个与癌细胞表面 GPC3 结合的抗原结合片段(Fab)结构域、一个与人类 T 细胞受体(TCR)结合的纳米抗体结构域以及一个与 T 细胞上表面人 CD8 共受体结合的纳米抗体结构域组成。
体外研究表明,AZD9793 通过与 CD8/TCR 结合,优先招募 CD8+ T 细胞,从而有效杀伤肝癌细胞,同时减少 CD4+ T 细胞的激活。与传统 GPC3/CD3 TCE 相比,这种偏向性显著限制了 CRS 相关细胞因子的产生。
在人源化小鼠模型中,AZD9793 通过增强 T 细胞浸润并提高肿瘤内 CD8/CD4 T 细胞的比例,对肝癌和非小细胞肺癌异种移植物展现出强大且具有剂量依赖性的抗肿瘤功效。此外,AZD9793 可通过依赖于 γ 干扰素(IFN-γ)的机制介导对肿瘤微环境中抗原阴性细胞的旁观者杀伤效应,并能有效控制异质性表达 GPC3 的肿瘤。
汇宇制药:创新免疫检查点协同型靶向
PD-L1/MSLN/CD3 三特异性 TCE
HY05350 是汇宇制药自主研发的靶向 PD-L1/MSLN/CD3 三特异性 TCE,可以通过 CD3 抗体识别并招募 T 细胞,通过 MSLN 抗体和/或 PD-L1 抗体识别并靶向肿瘤细胞,同时通过 PD-L1 抗体解除肿瘤细胞对 T 细胞的免疫抑制作用重新激活免疫细胞。
体内外研究表明,相较于传统双特异性抗体(MSLN/CD3),HY05350 能够诱导更强的 T 细胞激活第二信号。其关键在于 CD3/PD-L1 结构域可靶向抗原呈递细胞表面的 PD-L1,通过激活 APC 间接增强 T 细胞功能,进而触发比直接桥接 T 细胞与癌细胞更高效的抗肿瘤免疫反应,显著提升治疗效能。
在多种人源肿瘤细胞系异种移植小鼠模型中,HY05350 表现出了强大的抗肿瘤活性。食蟹猴的 GLP 毒性研究表明,HY05350 耐受性良好,其毒性特征与典型的基于 CD3 的双特异性抗体相当,并且具有可接受的药代动力学/药效学(PK/TK)特征,半衰期为 12 至 35 小时。
齐鲁制药:MET/EGFR/CD2/CD3
靶向四特异性 TCE
QL615 是基于齐鲁制药 TECAD 平台开发的四特异性 TCE,该平台通过独特的四特异性分子设计与 CD2 条件激活介导的 CD3 共刺激机制有效地解决肿瘤选择性不足和效力有限的问题。
细胞结合实验证实,QL615 对同时表达 MET 和 EGFR 的肿瘤细胞展现出纳摩尔级别的半最大效应浓度(EC50);而在仅低水平表达单一靶点(MET 或 EGFR)的细胞上,其结合力近乎可忽略,显著降低脱靶风险。
QL615 对双阳性肿瘤细胞的裂解选择性超过 1000 倍;与仅具备 CD3 重定向功能的传统构建体相比,TECAD 平台借助 CD2 共刺激作用,使肿瘤细胞杀伤能力提升约 30 倍。在体内实验中,QL615 更展现出优于同类在研产品的肿瘤生长控制效果。
维立志博:靶向新型靶点 LILRB4 的双特异性 TCE
LILRB4 属于 LILRB 家族,是 I 型跨膜蛋白,其结构包含两个胞外 Ig 结构域、一个跨膜结构域及三个胞质免疫受体酪氨酸抑制基序(ITIM),主要参与免疫应答的负向调控。研究发现,LILRB4 在多发性骨髓瘤(MM)中呈现高特异性表达,使其成为极具潜力的 MM 靶向治疗靶点。
LBL-043 由维立志博基于自主研发的 LeadsBody CD3 双抗技术平台开发,是一款靶向 LILRB4 的双特异性 TCE。该 TCE 具有独特的分子设计和作用机制,LBL-043 只有在靶细胞表达 LILRB4 的情况下才能够进行特异性的靶向杀伤,且对 LILRB4 高表达和低表达的肿瘤细胞均能展现出强效的杀伤。
在 NCI-H929 人源肿瘤细胞系异种移植小鼠模型中,LBL-043 显示出显著的抗肿瘤活性。药物毒理学评估中的剂量探索研究表明,LBL-043 在食蟹猴中具有良好的安全性。

 产业资讯
产业资讯
 谈思生物
谈思生物  2025-11-25
2025-11-25
 17
17

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-11-25
2025-11-25
 17
17

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-25
2025-11-25
 16
16