 产业资讯
产业资讯
 药明康德
药明康德  2025-05-07
2025-05-07
 619
619
编者按:今年初,行业媒体Evaluate发布报告,梳理了预计于2025年上市的关键创新疗法。随着2025年进程已过三分之一,我们也对这些潜在重磅疗法的最新进展进行回顾。在报告列出的十项疗法中,有五款为小分子药物,充分体现了小分子药物在2025年生物医药创新格局中所占据的重要地位。在这五款小分子潜力疗法中,药明康德化学业务平台很高兴为其中两款提供了赋能服务,助力合作伙伴加速创新成果转化。面向未来,药明康德将持续发挥平台优势,携手全球客户,推动更多创新疗法早日惠及全球患者。

图片来源:123RF
在这份报告中所提到的10款潜在重磅疗法当中,已有5款率先获得美国FDA批准,包含由Vertex Pharmaceuticals所开发,在去年底获批用以治疗囊性纤维化(CF)患者的Alyftrek;由阿斯利康(AstraZeneca)与第一三共(Daiichi Sankyo)联合开发用以治疗乳腺癌的Trop2靶向抗体偶联药物(ADC)Datroway(datopotamab deruxtecan),以及同样由Vertex Pharmaceuticals所开发、用于治疗急性疼痛的Journavx(suzetrigine)则在今年1月分别接连获得FDA批准;而由GSK所开发的脑膜炎球菌疫苗Penmenvy(MenABCWY)则在2月获批;强生开发的抗体疗法Imaavy(nipocalimab)在4月底获批治疗全身性重症肌无力(gMG)。
值得注意的是,在这些潜在重磅疗法当中,有不少具有显著的创新性。例如,由GSK所开发的depemokimab是在3期试验中进行评估的首个白细胞介素5(IL-5)靶向超长效生物制品。根据新闻稿,该疗法可能成为仅须每6个月给药一次、用于治疗严重哮喘的首个获批超长效生物制品。而Vertex Pharmaceuticals的新闻稿则指出,其NaV1.8抑制剂suzetrigine为二十多年来首个用于治疗急性疼痛的新机制药物。此外,强生(Johnson & Johnson)旗下新生儿Fc受体(FcRn)靶向单抗nipocalimab具有治疗多种免疫疾病的潜力,获批治疗gMG之外,它还是在干燥综合征(Sjögren’s disease,SjD)领域获得突破性疗法认定(BTD)的首款疗法。

▲2025年10款潜在重磅疗法一览(图表来源:根据参考资料[1]整理制表)
在列出的10款潜在重磅疗法中,小分子药物占据一半(5款,占比50%);单克隆抗体疗法占据2款(占比20%);而抗体偶联药物(ADC)、多肽药物及疫苗各自占据1款(各占比10%)。这一分布进一步印证了小分子药物在2025年生物医药创新版图中举足轻重的地位。
2025年的十款潜在重磅疗法
疗法:Alyftrek(vanzacaftor/tezacaftor/deutivacaftor)
公司:Vertex Pharmaceuticals
研发状态:2024年12月20日获美国FDA批准
Alyftrek是一款下一代囊性纤维化跨膜电导调节因子(CFTR)调节剂三联疗法,该疗法在去年12月获FDA批准用于治疗6岁及以上、携带至少一个F508del突变或其他对Alyftrek有应答的CFTR基因突变的囊性纤维化患者。在两项随机双盲3期临床试验中,接受治疗24周后,基于一秒用力呼气量百分比(ppFEV1)数值的评估,Alyftrek的疗效与获批CF疗法Trikafta相当,达到试验的主要终点。此外,Alyftrek在降低汗液氯化物(SwCl)水平方面与活性对照药物相比表现出优效性,这是两项3期试验的关键次要终点之一。
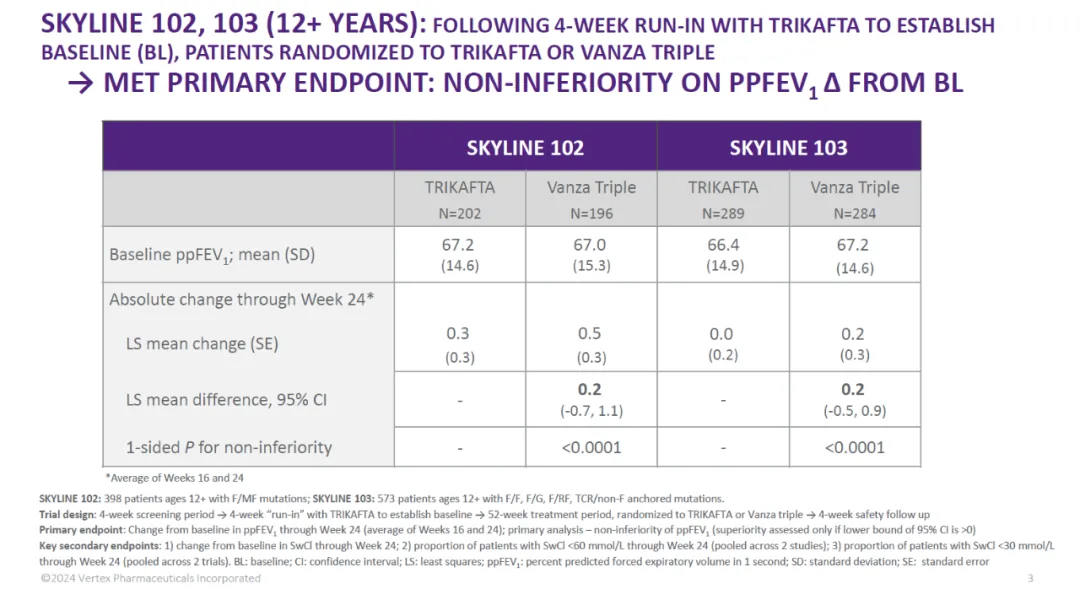
▲Alyftrek在SKYLINE 102和SKYLINE 103试验中达到主要终点(图片来源:Vertex公司官网)
疗法:Datroway(datopotamab deruxtecan,Dato-DXd)
公司:阿斯利康、第一三共
研发状态:2025年1月17日获美国FDA批准
Datroway是一款由人源化、靶向Trop2的单克隆抗体与创新DNA拓扑异构酶I抑制剂(DXd),通过可裂解的四肽连接子偶联生成的ADC。该疗法在今年1月获FDA批准上市,用于治疗无法切除或转移性HR阳性、HER2阴性的成年乳腺癌患者,这些患者曾接受过内分泌疗法和化疗。美国FDA的批准主要基于TROPION-Breast01临床3期试验的结果。分析显示,Datroway治疗组的中位无进展生存期(PFS)为6.9个月(95% CI:5.7,7.4),化疗组为4.9个月(95% CI:4.2,5.5),即Datroway相较于化疗,可将患者的疾病进展或死亡风险降低37%(HR=0.63,95% CI:0.52,0.76,p<0.0001)。Datroway与化疗组患者的确认客观缓解率(ORR)分别为36%(95% CI:31,42)和23%(95% CI:19,28)。今年1月,美国FDA授予Datroway优先审评资格用于治疗局部晚期或转移性表皮生长因子受体突变(EGFRm)的非小细胞肺癌(NSCLC)成人患者,预计将在2025年第三季度完成审评。
疗法:Journavx(suzetrigine)
公司:Vertex Pharmaceuticals
研发状态:2025年1月30日获美国FDA批准
Suzetrigine是一种口服选择性NaV1.8抑制剂,与其它NaV离子通道相比,它对NaV1.8具有高度选择性。根据关键性3期临床试验的积极结果,suzetrigine在急性疼痛治疗中表现出显著效果。具体来说,在接受腹部整形手术(abdominoplasty)患者中进行的3期临床试验结果显示,suzetrigine达到了试验的主要终点,与安慰剂相比,药物组患者48小时内疼痛强度差异的时间加权总和评分(SPID48)显著降低,SPID48的平均差异为48.4(95% CI:33.6,63.1;P<0.0001)。此外,患者在手术48小时后的数值疼痛评分量表(NPRS)评分与基线相比也显著降低。而在接受拇囊炎切除手术(bunionectomy)的患者中,该疗法亦达成主要终点,SPID48的平均差异为29.3(95% CI:14.0,44.6;P=0.0002)。
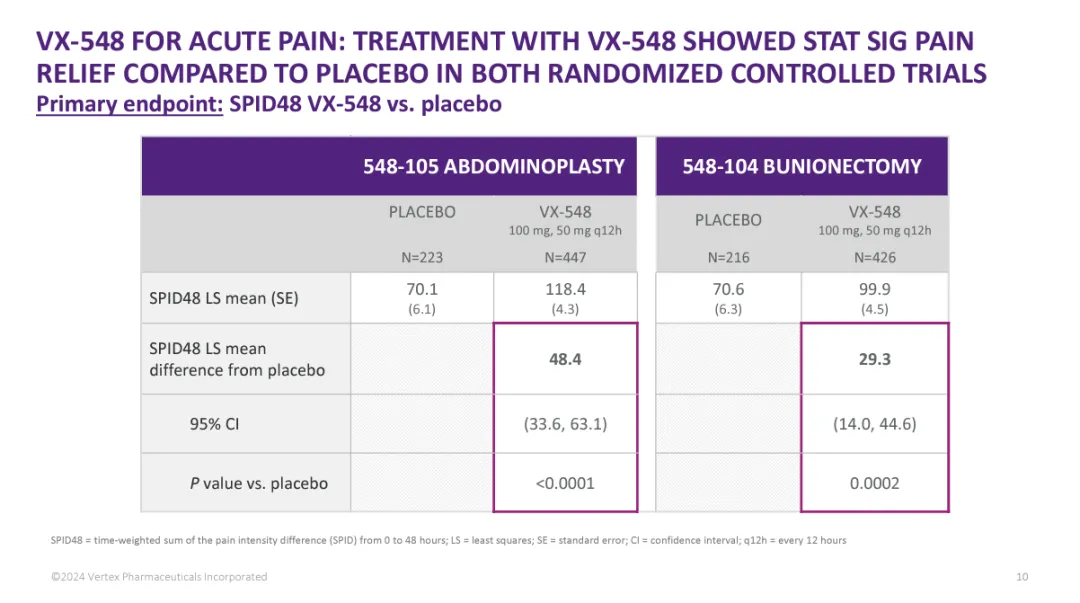
▲Suzetrigine达成试验主要终点(图片来源:Vertex官网)
疗法:Aficamten
公司:Cytokinetics
研发状态:PDUFA日期为2025年12月26日
Aficamten是一种下一代心肌球蛋白抑制剂,用于治疗梗阻性肥厚型心肌病(HCM)。该药物的上市申请主要基于关键性3期临床试验SEQUOIA-HCM结果。分析显示,与安慰剂相比,aficamten治疗24周显著提高了患者的运动能力。通过心肺运动试验(CPET)测得的峰值氧气摄取量(pVO2)与基线相比,在aficamten治疗组增加了1.8 ml/kg/min,而安慰剂组为0.0 ml/kg/min。此外,接受aficamten治疗的患者在10个预先设定的次要终点中,均观察到了统计学上显著的改善。FDA曾于2021年12月授予aficamten治疗梗阻性HCM的突破性疗法认定。
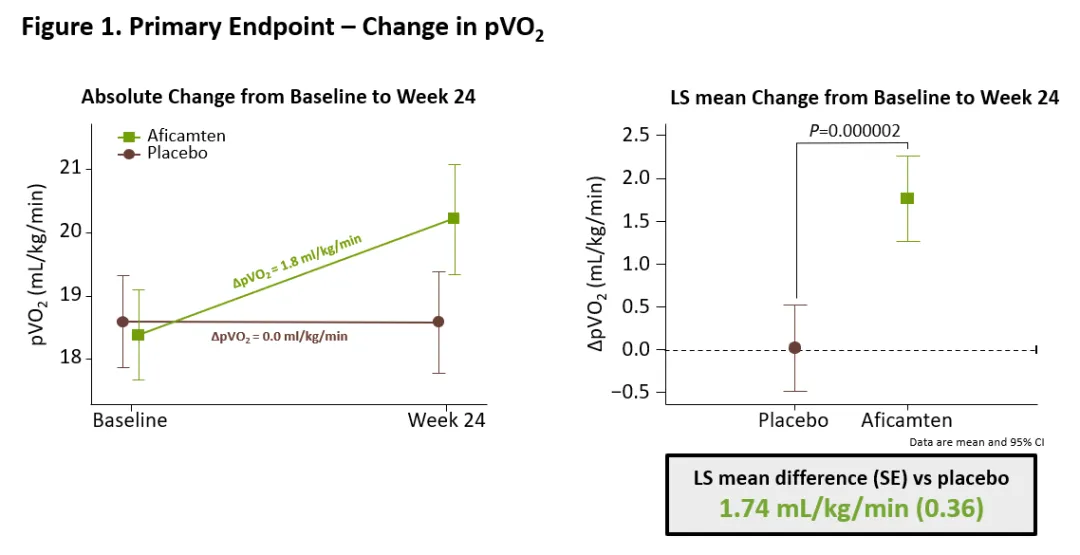
▲Aficamten达到SEQUOIA-HCM试验的主要终点(图片来源:Cytokinetics官网)
疗法:Brensocatib
公司:Insmed
研发状态:PDUFA日期为2025年8月12日
Brensocatib是一种口服、可逆性DPP1小分子抑制剂。DPP1是一种酶,负责激活中性粒细胞中的中性粒细胞丝氨酸蛋白酶(NSPs)。Brensocatib可通过抑制DPP1降低NSPs的活化,从而降低炎症性疾病(如支气管扩张)的组织损伤。这款疗法已经获得美国FDA授予的突破性疗法认定,用于治疗非囊性纤维化支气管扩张。一项包含1680名成人和41名青少年非囊性纤维化支气管扩张症患者的临床试验结果显示,试验达到主要终点,10 mg和25 mg剂量的brensocatib分别将患者的年化肺部症状恶化(PE)率降低21.1%和19.4%,统计学显著并具有临床意义。
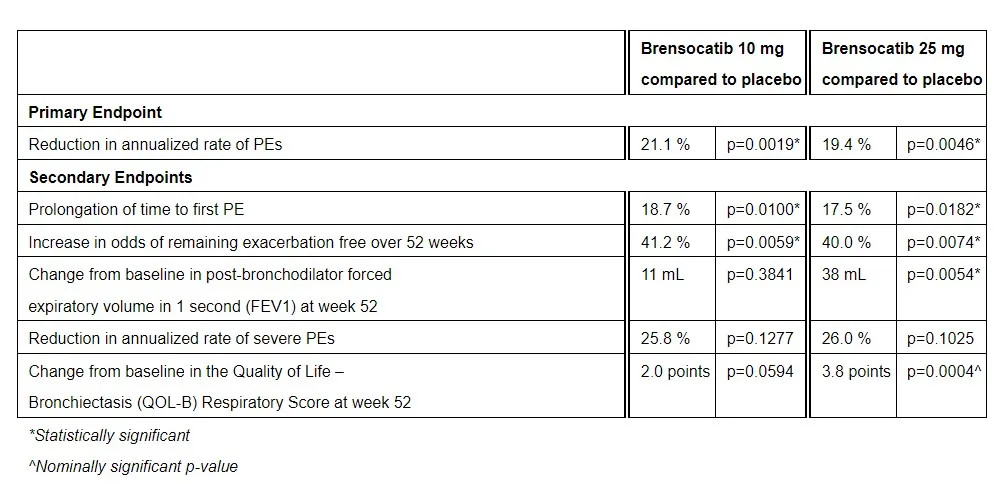
▲Brensocatib的3期临床试验疗效数据(图片来源:参考资料[4])
疗法:Tolebrutinib
公司:赛诺菲(Sanofi)
研发状态:PDUFA日期为2025年9月28日
Tolebrutinib是一款在研口服、能穿越血脑屏障且具有生物活性的布鲁顿氏酪氨酸激酶(BTK)抑制剂,它能够达到足以调节B淋巴细胞和疾病相关小胶质细胞的脑脊液浓度。临床3期试验结果表明,tolebrutinib与安慰剂相比,可将非复发性继发进展型多发性硬化(nrSPMS)出现6个月确认残疾进展(CDP)的时间延缓31%(HR=0.69;95% CI,0.55-0.88;p=0.0026)。进一步的次要终点分析显示,接受tolebrutinib治疗的参与者中,确认残疾获得改善的患者比例(10%)是安慰剂组(5%)的两倍(HR=1.88;95% CI,1.10-3.21)。Tolebrutinib目前正在多个3期临床试验中评估其治疗多种类型多发性硬化的潜力。该疗法在2024年12月获得FDA授予突破性疗法认定,用于治疗nrSPMS成年患者。
▲Tolebrutinib分子结构(图片来源:PubChem)
疗法:玛仕度肽(Mazdutide,IBI362)
公司:信达生物(Innovent)、礼来(Eli Lilly and Company)
研发状态:在中国用于治疗肥胖与2型糖尿病治疗的监管申请结果预定分别在2025年上半年与下半年公布
玛仕度肽是信达生物与礼来共同推进的一款胰高血糖素样肽-1受体(GLP-1R)和胰高血糖素受体(GCGR)双重激动剂。之前发布于eClinicalMedicine期刊上的一篇研究结果显示,接受每周一次9 mg玛仕度肽皮下注射治疗的受试者从基线至第12周体重的平均百分比变化为-11.7%,接受安慰剂治疗的受试者为-1.8%(估计治疗差异:-9.8%;95% CI:-14.4,-5.3;P=0.0002)。安全性方面,玛仕度肽的耐受性良好,并具有良好的安全性。未报告严重不良事件。所有治疗相关不良事件均为轻度或中度。

疗法:Depemokimab
公司:GSK
研发状态:PDUFA日期为2025年12月16日
Depemokimab是在3期试验中进行评估的首个白细胞介素5(IL-5)靶向超长效生物制品。SWIFT-1和SWIFT-2临床3期试验结果显示,试验达主要终点,depemokimab可显著降低严重哮喘患者的哮喘发作率达54%(HR=0.46,95% CI:0.36–0.59,p<0.001),这些患者具有2型炎症特征(以血液嗜酸性粒细胞计数为标志)。此外,试验亦达成次要终点。与安慰剂相比,患者需要住院或急诊救治的临床显著恶化减少达72%(HR=0.28,95% CI:0.13–0.61,p=0.002)。GSK预计在2025年启动该疗法用于治疗慢性阻塞性肺病(COPD)患者的3期临床试验。根据新闻稿,depemokimab可能成为仅须每6个月给药一次、用于治疗严重哮喘的首个获批超长效生物制品。

疗法:Penmenvy(MenABCWY)
公司:GSK
研发状态:2025年2月14日获美国FDA批准
五种脑膜炎球菌血清群(A,B,C,W和Y)占全球大部分地区的几乎所有侵袭性脑膜炎球菌病病例。GSK的五合一MenABCWY疫苗结合已获批的脑膜炎疫苗Bexsero和Menveo的抗原成分,可针对这五种血清群的脑膜炎球菌保护接种者。将两种有效疫苗合并为一种的目的是帮助简化免疫接种计划,进而增加疫苗覆盖率,帮助减少疾病的总负担。在3期试验中,MenABCWY疫苗成功达到所有主要终点,包括在免疫原性方面不劣于一剂GSK的A、C、Y和W群脑膜炎球菌疫苗,以及在对110种不同的B群脑膜炎球菌侵袭性菌株产生的免疫反应上,不劣于两剂GSK的B群脑膜炎球菌疫苗。此外,该疫苗显示出良好的耐受性,其安全性与上述两种疫苗一致。
疗法:Nipocalimab
公司:强生
研发状态:2025年4月29日获美国FDA批准
Nipocalimab是一款潜在“best-in-class”,靶向新生儿Fc受体的抗体疗法。它通过与FcRn结合,让被单核细胞和内皮细胞摄入的自身抗体不会重新释放到血液中,而是在细胞内被降解。已有研究显示,它可以将血液循环中包括致病自身抗体在内的IgG水平降低超过75%。它在4月29日获FDA批准,治疗抗AChR、抗MuSK抗体阳性的全身性重症肌无力(gMG)成人与12岁以上儿童患者。强生公司还在罕见自身抗体疾病、母体同种抗体介导的母胎疾病和风湿病领域探索nipocalimab的潜力。它在去年11月获得FDA授予突破性疗法认定,用于治疗中度至重度SjD成人患者。根据新闻稿,nipocalimab是在SjD领域获得突破性疗法认定的首个疗法。DAHLIAS临床2期试验结果显示,nipocalimab达到主要终点,从第4周开始,15 mg/kg nipocalimab组患者就开始获得缓解,并在整个24周的治疗期间持续增加。在第24周,与安慰剂相较,15 mg/kg组受试者在主要终点上,显示出平均系统性疾病活动程度相对于安慰剂超过70%的改善。
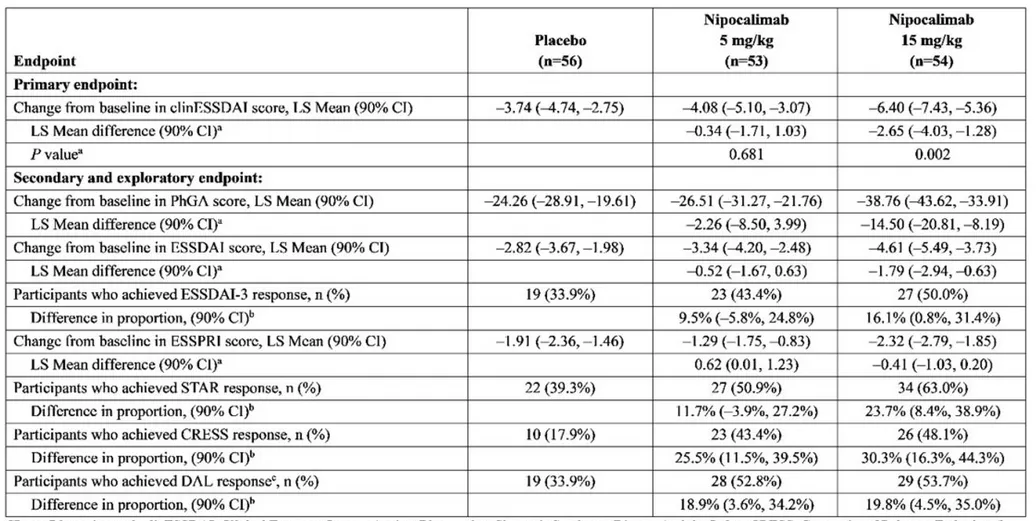
▲DAHLIAS研究疗效结果摘要(图片来源:参考资料[5])
 产业资讯
产业资讯
 药渡
药渡  2025-11-07
2025-11-07
 0
0
 产业资讯
产业资讯
 药时代
药时代  2025-11-07
2025-11-07
 13
13

 产业资讯
产业资讯
 瞪羚社
瞪羚社  2025-11-07
2025-11-07
 1
1