 产业资讯
产业资讯
 医药魔方
医药魔方  2025-05-20
2025-05-20
 676
676
阿尔茨海默病药物研发,是勇敢者的冒险。从1910年疾病首次被命名至今,无数的努力和资金“打了水漂”。
然而,以Aβ假说、Tau假说、神经炎症假说为代表的多种假说的发展,对APOE4等遗传风险因素的深入研究,以及新兴靶点的不断涌现,推动着全球药企、Biotech在阿尔茨海默病(AD)赛道持续攻关,这场接力也让曾被称为药物研发“死亡谷”的AD领域逐渐焕发生机。
过去4年,FDA接连批准3款Aβ单抗上市,AD开启了靶向治疗新时代。Aβ单抗的成功获批也推动了AD药物研发浪潮。基于Aβ假说,除抗体药物外,口服小分子Aβ抑制剂研发备受关注,被认为有望成为AD治疗新的“破局者”。
口服Aβ抑制剂:AD治疗新曙光
4月10日,Alzheon公布了全球进展最快的口服小分子Aβ抑制剂ALZ-801(valiltramiprosate)治疗携带两个拷贝APOE4基因的早期AD患者(包括轻度认知障碍及轻度AD痴呆患者)的关键性III期APOLLOE4研究的顶线结果。
ALZ-801是一款潜在first-in-class药物,可抑制β淀粉样蛋白(Aβ)错误折叠,稳定单体,阻断聚集,从而抑制可溶性神经毒性淀粉样蛋白寡聚体的形成。作为全球开发进度最快的口服Aβ聚集抑制剂,ALZ-801的一举一动备受瞩目。
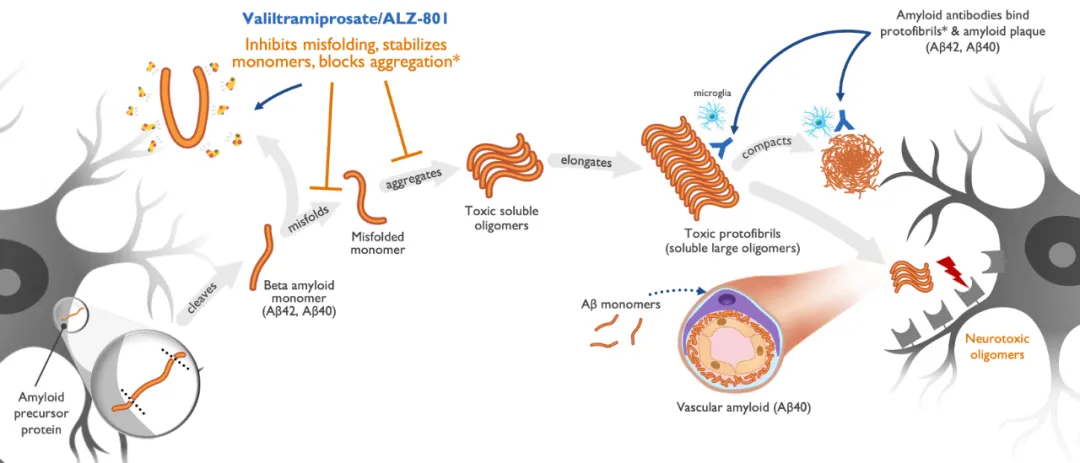
来源:Alzheon
此次公布的APOLLOE4研究是全球首个专注于APOE4/4纯合子患者的III期试验(NCT04770220),也是迄今为止针对此类患者进行的最大规模的临床试验。试验招募了325名早期AD患者,分为轻度认知障碍(Mild Cognitive Impairment, MCI)和轻度AD痴呆两类,旨在评估每日两次口服265mg ALZ-801治疗78周在APOE4/4纯合子早期AD患者中的疗效、安全性、生物标志物和影像学效果。
携带APOE4/4纯合子基因型的人群是AD高危群体。APOE4/4纯合子个体会形成更多的神经毒性淀粉样蛋白寡聚体(会损害神经元及突触,驱动AD的发展),导致疾病发病更早,并且患者迅速进展至疾病晚期的可能性更高。
在APOLLOE4 III期试验中,ALZ-801治疗改善了APOE4/4纯合子MCI患者的认知和功能,减缓了总研究人群中多个脑区域的脑萎缩,且安全性结果良好,没有增加血管源性脑水肿的风险。
具体来看,尽管在总人群中,ALZ-801与安慰剂组相比,阿尔茨海默病认知功能评价量表评分(ADAS-Cog13)无显著获益,但在MCI人群中,ALZ-801组与安慰剂组相比,ADAS-Cog13显示名义上统计学显著的临床获益(52%获益,p=0.041);此外,临床痴呆评定量表总和评分(CDR-SB)及痴呆残疾评估(DAD)均具有临床获益(下表)。
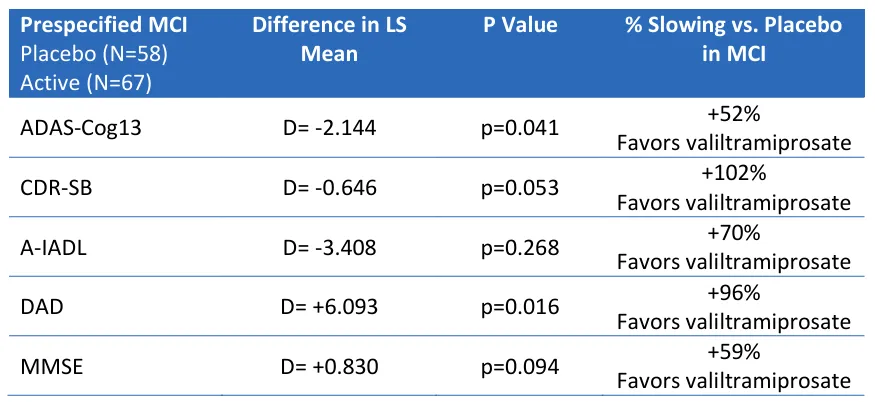
来源:Alzheon
基于磁共振成像(MRI)的分析显示,在整体人群中,多个脑区脑萎缩减慢;在MCI人群中,效果更加显著:海马体体积、全脑皮质厚度及全脑体积指标获益比例分别为26%(p=0.0042)、35%(p<0.0001)和22%(p=0.0267),表明ALZ-801具有潜在的神经保护作用。
安全性方面,未见报告严重不良反应,未发生死亡事件,未观察到血管源性脑水肿(ARIA-E)或微出血(ARIA-H)风险升高。ALZ-801组和安慰剂组发生ARIA-E 的比例均为3.4%,发生ARIA-H的比例分别为9%和14%,发生ARIA-铁质沉积的比例分别为5%和6%。在总人群中,ALZ-801组与安慰剂组的严重不良事件(SAE)发生率相似。而在MCI患者中,ALZ-801组的SAE发生率更低(5% vs 8%)。最常见的治疗中出现的不良事件(TEAE)为恶心、体重减轻、食欲下降和呕吐。
整体来看,具有差异化作用机制的ALZ-801为高危APOE4/4纯合子MCI患者的认知和功能带来了明确的获益,进一步支持AD治疗应在尽早阶段开始的理念。此外,相比Aβ单抗药物(会引起ARIA等严重副作用),ALZ-801展现出了一定的安全性优势;同时,作为口服小分子药物,其具备患者依从性优势。结合APOE4/4基因型患者现有治疗的局限性,Alzheon对ALZ-801的上市保持乐观。
据悉,Alzheon正在开展一项长期延长试验(NCT06304883),在完成核心APOLLOE4研究的受试者中评估额外进行52周ALZ-801治疗的长期安全性及疗效。这项APOLLOE4-LTE 研究目前正在美国、英国和加拿大进行。
此外,值得一提的是,ALZ-801初始的III期试验聚焦携带APOE4/4纯合子的早期AD患者,未来可能会扩展到携带一个APOE4拷贝或不携带APOE4的患者,以进行AD治疗及预防。Alzheon已经完成了ALZ-801针对APOE4/4或APOE3/4基因型早期AD患者的一项II期生物标志物试验(NCT04693520)。若治疗能拓展到APOE4单拷贝患者,那将大大增加AD获益人群,同时为ALZ-801打开更广阔的市场空间。
作为口服Aβ抑制剂的代表性分子,ALZ-801的开发推动了小分子Aβ抑制剂赛道的发展,全球多家公司正在该领域积极布局。国内方面,由润佳医药自主研发的口服小分子1类创新药RP902进展最快,是国内首个获批临床的小分子Aβ抑制剂,用于治疗携带APOE4基因的AD患者。
RP902与ALZ-801机制相似,可显著抑制大脑中与AD患者认知功能下降直接相关的神经毒性可溶性淀粉样蛋白寡聚体的形成。同时,RP902可有效保护脑血管及血脑屏障,从而减少或延缓对神经元的损伤。
临床前研究表明,RP902在包括APP/PS1转基因小鼠在内的多个动物模型中显示出良好的认知功能改善,包括工作记忆、形象识别记忆、空间记忆和长期记忆障碍;同时显著改善模型动物海马及大脑皮层神经细胞及树突损伤,提高突触可塑性;降低模型小鼠脑内Aβ沉积以及脑内可溶与不可溶性Aβ1-40和Aβ1-42的含量。RP902同样具有良好的安全性,未产生淀粉样蛋白相关影像学异常(ARIA)这一抗体药常见的不良反应。
根据药物临床试验登记与信息公示平台数据,目前RP902的I期临床研究(CTR20230433; CTR20232323)已完成,临床II/III期研究将于2025年正式启动,其针对APOE4携带者/纯合子早期AD患者,尤其是MCI患者的临床数据值得关注。
借鉴“他山之石”,打破AD治疗僵局
阿尔茨海默病(AD)是一种会导致记忆力和其他认知功能逐渐衰退的毁灭性神经退行性疾病,多发于中老年,是60%-70%痴呆病例的病因,诊断后的平均预期寿命为3至12年。据估计,AD正影响着全球几千万人,其中,中国约有1000万AD患者。
——高危风险人群——
阿尔茨海默病病因复杂,但大量研究表明,载脂蛋白E (APOE)基因多态性是迟发性阿尔茨海默病(占AD总人群的95%以上)的主要遗传风险决定因素。
与常见的APOE3等位基因相比,APOE4与AD患病风险增加相关,APOE2与患病风险降低相关。携带一个拷贝APOE4的个体患迟发性AD的风险增加3-4倍,携带两个拷贝APOE4(APOE4/4纯合子)的个体患迟发性AD的风险增加9-15倍。此外,有研究表明,APOE4也与较低的发病年龄相关。与 APOE4非携带者相比, 携带一个拷贝APOE4使AD的发病时间提前2~5年, 携带APOE4/4纯合子使AD的发病时间提前5~10年。
AD的病理特征包括Aβ聚集体沉积为淀粉样斑块、高度磷酸化的Tau聚集成神经原纤维缠结,伴随着神经元的丢失和胶质细胞的激活。研究表明,携带APOE4会增加大脑中的Aβ病理,损害正常脑功能的多个方面,从而增加患AD的风险。此外,APOE4还能够显著加剧Tau介导的神经变性。
2024年5月发表在Nature Medicine上的一项重要研究表明,几乎所有的APOE4纯合子参与者都表现出AD病理。到65岁时,几乎所有APOE4纯合子参与者的脑脊液中淀粉样蛋白(Aβ1-42)水平异常。APOE4纯合子出现症状的年龄也更早,为65.1岁。
相关数据显示,65%-70%的AD患者携带至少一个拷贝的APOE4(APOE3/4或APOE4/4基因型)。APOE4/4纯合子基因型AD患者占AD总人群的15%。这些高危群体迫切需要个性化的临床试验及更加安全、有效的治疗药物。
——黄金窗口期——
从病程的角度,AD主要分为三个阶段:临床前期(前驱期AD)、轻度认知障碍(MCI)和痴呆(分轻度、中度及重度)。研究表明,MCI患者可以逆转为认知正常状态,因此,在MCI阶段开展早期诊断与干预是改善认知功能,延缓疾病进展,甚至逆转疾病的 “黄金窗口期”。
过去几年,AD药物开发逐渐显示出从MCI及轻度AD痴呆患者实现突破的趋势。以两款最新获批的Aβ单抗为例:
2024年7月,FDA批准礼来的多奈单抗(donanemab)用于治疗早期AD成人患者(患者有确诊的淀粉样蛋白病理改变),包括MCI患者和轻度AD痴呆患者。值得一提的是,在关键III期研究TRAILBLAZER-ALZ 2中,疾病更早阶段患者使用多奈单抗的效果更好。
2023年更早在美国获批的仑卡奈单抗(lecanemab)同样建议应在MCI或轻度痴呆阶段的患者中开始治疗。Lecanemab是目前唯一被批准的除了靶向和减少Aβ斑块(不溶性Aβ聚集物)外,还能优先结合和清除有毒原纤维(可溶性Aβ聚集物)的Aβ单抗。
以Alzheon的ALZ-801、润佳医药的RP902为代表小分子Aβ抑制剂在淀粉样蛋白级联反应上游发挥作用,抑制可溶性神经毒性淀粉样蛋白寡聚体的形成。此类分子能否在“黄金窗口期”为携带APOE4基因(杂合子或纯合子)的高危MCI患者或轻度AD痴呆患者带来更便捷、更有效、更安全的治疗选择,值得关注。
基于Tau假说的药物研发是AD领域的另一大主流方向。该领域同样显示出了从早期AD突破的趋势。举例来看,口服Tau聚集抑制剂hydromethylthionine mesylate (HMTM)已在英国申报上市,用于治疗MCI及AD轻度及中度痴呆患者。Biogen处于II期临床(NCT05399888)的反义寡核苷酸疗法(BIIB080)同样针对MCI或轻度AD痴呆患者,近期刚刚获得了FDA的快速通道认定。
基于“APOE4与增加AD风险有关,APOE2与降低AD风险有关”相关发现,全球多家公司也正在开展APOE相关药物的研发。代表性公司LEXEO Therapeutics现有3款基因疗法(LX1001、LX1020、LX1021)在研,其中,LX1001是一款递送APOE2基因疗法,用于治疗APOE4纯合子早期AD患者,以阻止或减缓疾病进展,现已进入I/II期临床开发阶段。
事实上,针对携带特定生物标志物的高危人群展开药物研发突破在医药史上已有很多成功案例,例如针对HER2阳性乳腺癌开发出的多款重塑诊疗格局的突破性药物,如曲妥珠单抗、恩美曲妥珠单抗(ADC)、德曲妥珠单抗(ADC)等。其中,德曲妥珠单抗(DS-8201)不仅获批用于HER2阳性乳腺癌,适应症更是扩展到了HER2低表达乳腺癌患者(约占乳腺癌总数的50%),大大扩展了可受益于HER2靶向治疗的乳腺癌患者群体,对患者和企业实现了双重利好。市场预测DS-8201有望成为史上首个年销售额百亿美元级别的ADC药物。DS-8201以HER2阳性乳腺癌为起点,改写乳腺癌临床实践的案例或可为AD等复杂疾病的药物研发带来启示。
——小结——
AD药物研发经历了漫长的挫折期,目前仍是最缺乏有效疗法的严重疾病之一。尽管Aβ单抗的成功上市翻开了AD治疗的新篇章,但攻克AD的征途还远未达到终点。 “预防、逆转、治愈AD”的课题仍摆在制药人面前。
站在过往无数科学研究及临床探索的肩膀上,AD药物研发逐渐走向一个共识:从AD早期阶段入手,从高危人群入手,或许是AD药物研发真正的突破口。
当前AD药物研发百花齐放,从传统抗体、小分子、疫苗,到小核酸药物、基因疗法、蛋白降解剂等前沿技术,多种modality齐头并进;与此同时,AD诊断也在经历迭代变革,FDA刚刚批准了首个用于AD诊断的血液检测(测量pTau217及Aβ1-42血浆比值),有望大大提升AD早诊早治。期待这些突破早日打破AD治疗僵局,为全球数千万患者带来期盼已久的甘霖。
AD是研发“深海”,亦是商业化“蓝海”。这一赛道蕴藏着诞生超级重磅炸弹药物的巨大机遇。勇敢的航海者不惧风险,未来终将有人主导这片海域。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 19
19

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 20
20

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 19
19