 产业资讯
产业资讯
 医药魔方
医药魔方  2025-05-23
2025-05-23
 740
740
PD-(L)1药物问世已有11年,Keytruda(帕博利珠单抗)的销售峰值也逼近300亿美元并仍在刷新纪录,超越了前一代“药王”Humira(阿达木单抗)创下的最高纪录。这是抗肿瘤药物第一次登上如此高峰,也是肿瘤免疫治疗1.0时代的市场胜利。
而今,肿瘤治疗的创新潮流已汹涌奔向新的方向:抗体偶联药物(ADC)和T细胞衔接器(TCE)正引领下一代革命。ADC和TCE成为肿瘤治疗风口的逻辑清晰:前者可精准高效杀伤肿瘤细胞,具备替代传统化疗的潜力;后者可募集T细胞“大军”,是强化细胞免疫应答的关键武器。站上这两个风口,也就有可能成为下一个肿瘤治疗格局变革者。
中国药企正在抓住这一机会,迈威生物就是其中的生力军。2024年,迈威生物的9MW2821(Nectin-4 ADC)入选美国临床肿瘤学会(ASCO)年会口头报告,首次亮相即崭露头角;2025年,迈威生物又在美国癌症研究协会(AACR)年会上展示其新型payload和TCE技术平台的最新进展。
这些成果映射出迈威生物清晰的战略布局——通过ADC和TCE双平台驱动,在肿瘤治疗领域逐步构建差异化竞争优势,逐步完成从行业“新星”到创新药“高阶玩家”的跃级。
ADC布局:锚定蓝海区
迈威生物进军ADC的时间较早,当时这一概念还未在国内被炒热,不过部分靶点已隐隐有扎堆之势。考虑到这一点,迈威生物采取了明智的差异化策略——构建特色平台,避开HER2等靶点“红海区”,押注Nectin-4、B7-H3、CDH17等潜力靶点,以差异化管线破局。
9MW2821(Bulumtatug fuvedotin)作为迈威生物ADC管线的领军产品,是首个启动临床的国产Nectin-4 ADC,正试图打破Padcev(维恩妥尤单抗)一枝独秀的局面。
在尿路上皮癌(UC)这一核心战场上,9MW2821与先行者Padcev展开了实力角逐,已经在临床数据上展示出best in class(BIC)潜力。对于接受过一线治疗的UC患者,9MW2821的客观缓解率(ORR)达到了54.1%[1],这一数据已超越Padcev的表现(37.5%)[2]。而在一线治疗UC的探索中,9MW2821联合特瑞普利单抗将患者的ORR提高至87.5%,确认的ORR也高达80.0%[3],再次彰显其BIC潜力。这一突出表现为9MW2821争取到了CDE授予的第二项突破性疗法资格,用于联合特瑞普利单抗治疗既往未经系统治疗的、不可手术切除的局部晚期或转移性UC。
9MW2821和维恩妥尤单抗的一线UC临床数据
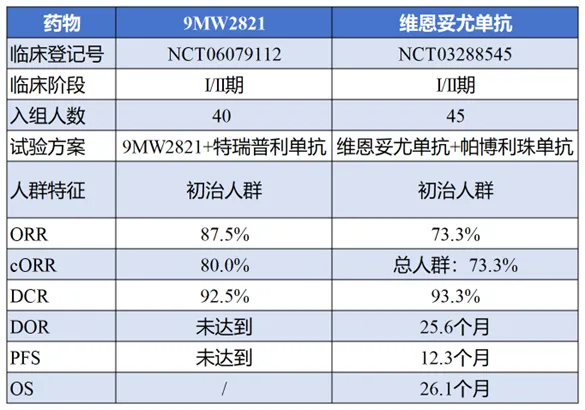
“ADC+PD-1”的联用模式正在成为肿瘤治疗的重要趋势,Padcev(维恩妥尤单抗)+Keytruda(帕博利珠单抗)已获FDA批准用于一线治疗UC。9MW2821与特瑞普利单抗的组合展现出了类似甚至更好的疗效,为中国乃至全球患者带来新的治疗希望。
9MW2821的差异化优势在三阴性乳腺癌(TNBC)适应症上更加明显。I/II期研究数据显示,拓扑异构酶抑制剂(TOPi)经治TNBC患者接受治疗后,ORR达到50.0%,与Padcev(维恩妥尤单抗)拉开较大差距[4]。
TNBC是乳腺癌预后最差的亚型,治疗选择有限,现有一线治疗药物仅有PD-(L)1药物,后线治疗药物(TROP2 ADC)的ORR为35.0%-45.4%[5-8],患者获益亟待提高。
考虑到目前获批和临床研究后期的ADC药物多使用TOPi为载荷,以MMAE为载荷的9MW2821有望为TOPi ADC经治TNBC患者的后续治疗提供保障。此外,9MW2821也在开展联合PD-1药物治疗TNBC的II期临床,有望为TNBC患者提供更有效的前线治疗选择。
在其它新兴靶点上的布局,迈威生物也有所收获。
7MW3711(B7-H3 ADC)在临床前研究中展现出了与PARP抑制剂联用的协同抗肿瘤活性,为前列腺癌治疗提供了新思路。此外,7MW3711联合PD-1药物的临床试验申请已在今年4月获批,这一组合也是同类产品的热门验证方向。在即将举行的ASCO 2025大会上,迈威生物将公布7MW3711的单药数据,这将是进一步验证该分子潜力的重要窗口。
7MW4911则聚焦胃肠道肿瘤高表达的靶点——CDH17。目前,全球临床阶段CDH17 ADC项目仍相对稀少,主要玩家包括普众发现、翰森制药、宜联生物等。迈威生物的7MW4911虽然仍处于临床前阶段,但其采用的创新载荷——非P-糖蛋白(P-gp)底物的MF-6,有望克服胃肠道肿瘤常见的多药耐药问题,带来显著的临床优势。
在ADC药物设计中,载荷的选择直接影响药物的疗效和安全性。MF-6是迈威生物通过其专有的Mtoxin平台开发的一种载荷,已应用于三款在研ADC产品——7MW3711、7MW4911和9MW2921,显示出广泛的应用前景。与此同时,迈威生物还与英矽智能合作,利用AI技术开发新型毒素,进一步强化技术壁垒。
从传统双抗到TCE,迈威生物玩法升级
随着免疫治疗的深入发展,TCE技术的应用已从血液瘤扩展至实体瘤,成为继ADC之后肿瘤治疗的下一个热点。在这一技术变革中,迈威生物的布局同样展现出前瞻性的战略视野。
最初,迈威生物在传统双抗领域试水,积累开发经验后进入TCE赛道。
在今年1月份披露的港交所招股书中,迈威生物首次透露了TCE双/三特异性抗体平台的建成。紧接着,该平台便在AACR 2025年会上正式亮相。这一平台的核心在于其精准的工程学设计,能够兼顾CD3亲和力、TCE format、肿瘤相关抗原(TAA)筛选及细胞因子释放综合征(CRS)风险等复杂因素。
为实现这一目标,迈威生物开发了一组具有不同结合特征和活化特性的经改造靶向CD3抗体,以及针对T细胞激活的二级信号的激动型抗体。同时,迈威生物建立了多组学的靶点筛选及评估体系,以鉴定肿瘤相关抗原(TAA)并确定其优先级。基于这些技术创新,迈威生物开发了高效且安全的1+1、1+2、2+2等多种TCE format,以适应不同肿瘤类型的治疗需求。
基于该平台设计的TCE分子能够精准控制T细胞激活的强度和持续时间,并且诱发CRS的风险也更低[9]。此外,它们可与食蟹猴CD3发生交叉反应,便于在非人灵长类动物模型中评估TCE介导的细胞毒性。
与TCE平台同时亮相的还有基于该平台研发的首个临床前项目——2MW7061。这是一款设计巧妙的1+2 TCE双抗,其结构包含两个靶向白细胞免疫球蛋白样受体B4(LILRB4)的Fab片段和一个靶向CD3的单链可变(scFv)片段,可通过空间位阻效应实现靶向依赖性T细胞激活。在临床前模型中,2MW7061对LILRB4低表达和高表达肿瘤均显示出了显著的抑制生长作用[10],并在非人灵长类动物中表现出良好的安全性,为后续临床开发奠定了基础。
在肿瘤治疗的组合玩法趋势下,TCE亦存在联用的可能性。
“TCE+ADC”或“TCE+IO”的组合已在全球范围内开展临床探索,初步数据显示出令人鼓舞的抗肿瘤活性。以罗氏的研究为例,在一项II期研究中,大B细胞淋巴瘤(LBCL)患者接受莫妥珠单抗联用维泊妥珠单抗治疗后,ORR达到了78%,并且有58%的患者实现了完全缓解(CR)[11]。这种联合治疗趋势,为拥有ADC和TCE双平台的迈威生物提供了广阔的战略空间。
“TCE+ADC/IO”组合临床试验开展情况
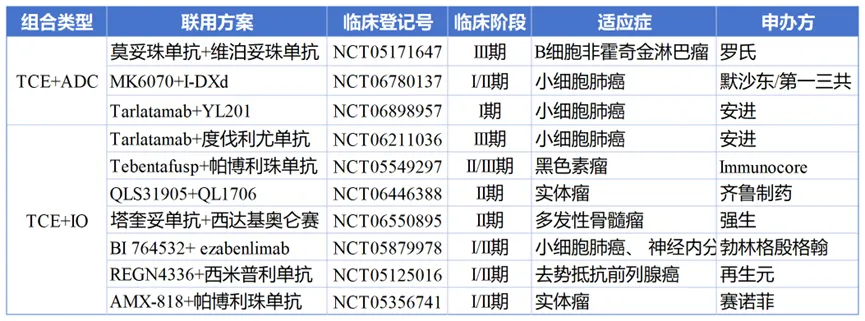
来源:医药魔方TrialCube数据库
总结
无论是单药开发还是联合治疗,ADC与TCE均具备广阔的市场空间。从目前来看,迈威生物凭借其前瞻性布局,以双技术平台为引擎,不仅构建了差异化的产品矩阵,更通过突破性临床数据展示了中国创新药企的全球竞争力,但竞争之下仍需加速临床转化并证明联合治疗策略的临床价值,方能在巨头林立的行业中稳固地位。
无论如何,从国际学术舞台上的频繁亮相,到多元化的技术平台和产品管线,迈威生物正一步步从肿瘤治疗领域的“新星”,成长为具有独特竞争力的“高玩”。在中国创新药企不断崛起的大背景下,这家企业正下一盘长远的战略棋局,其未来发展值得期待。

 产业资讯
产业资讯
 医药观澜
医药观澜  2025-11-06
2025-11-06
 11
11

 产业资讯
产业资讯
 药圈头条
药圈头条  2025-11-06
2025-11-06
 13
13

 产业资讯
产业资讯
 氨基观察
氨基观察  2025-11-06
2025-11-06
 12
12