 产业资讯
产业资讯
 医药观澜
医药观澜  2025-05-30
2025-05-30
 1998
1998
今日(5月29日),中国国家药监局(NMPA)官网最新公示,恒瑞医药1类新药注射用瑞康曲妥珠单抗的上市申请已获得批准。该项上市申请此前已经被中国国家药监局药品审评中心(CDE)纳入优先审评,适应症为:单药适用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
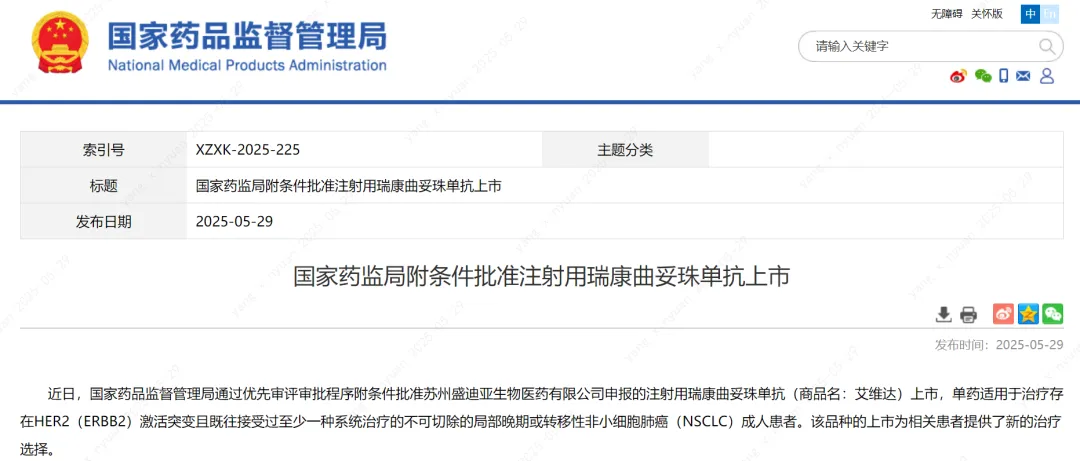
截图来源:NMPA官网
在晚期NSCLC患者中,约2~4%携带HER2激活突变,这些突变会导致HER2蛋白过度表达和过度激活,进而引发细胞异常增殖、抑制细胞死亡以及促进肿瘤生长和扩散。
注射用瑞康曲妥珠单抗(研发代号:SHR-A1811)是恒瑞医药自主研发的以HER2为靶点的抗体药物偶联物(ADC)。它可特异性结合肿瘤细胞表面上的HER2,通过组织蛋白酶水解释放游离毒素,从而抑制DNA拓扑异构酶I的活性,最终诱导肿瘤细胞的凋亡。由于其高透膜性,还存在较强的旁路杀伤效应。

本次瑞康曲妥珠单抗获批的适应症为非小细胞肺癌。2024年6月,瑞康曲妥珠单抗治疗HER2突变NSCLC患者的2期临床试验(SHR-A1811-I-103)主要研究终点结果达到方案预设的优效标准。该研究旨在评估瑞康曲妥珠单抗治疗HER2突变的晚期NSCLC受试者的抗肿瘤疗效和安全性。研究结果表明,与预设的历史数据相比,瑞康曲妥珠单抗单药在HER2突变NSCLC患者中取得了显著的且有临床意义的改善。
2024年7月,恒瑞医药宣布1/2期临床研究SHR-A1811-I-103研究的1期阶段主要结果在《自然》子刊Signal Transduction and Targeted Therapy发布。结果显示,全剂量组经研究者评估确认的客观缓解率(ORR)为38.1%,疾病控制率(DCR)为90.5%,中位反应持续时间(DOR)为10.3个月,中位无进展生存期(PFS)为9.5个月。4.8mg/kg剂量组(RP2D,N=43)经研究者评估确认的ORR为41.9%,DCR为95.3%,中位DoR为13.7个月,中位PFS为8.4个月。
2025年2月,恒瑞医药宣布HORIZON-Lung研究2期阶段主要结果发表于《柳叶刀·肿瘤学》(The Lancet Oncology)。2期阶段作为关键单臂研究,旨在评估瑞康曲妥珠单抗单药对HER2突变的晚期NSCLC受试者的抗肿瘤疗效和安全性。
研究结果显示,基于RECIST v1.1,IRC评估确认的ORR为73.4%,亚组ORR获益趋势与总体人群一致。根据Kaplan-Meier法估计,IRC评估的中位缓解持续时间(DoR)未达到,中位PFS为11.5个月,6个月PFS率为86.8%。基线有脑转移的患者,中位PFS为9.9个月,基线无脑转移的患者中位PFS为 11.5个月。3例(3.2%)受试者发生了总生存期(OS)事件,中位OS尚不成熟。
除了本次获批的非小细胞肺癌适应症,瑞康曲妥珠单抗已获批开展多项临床研究,其中乳腺癌、胃癌或胃食管结合部腺癌、结直肠癌等均进入3期研发阶段,旨在为HER2基因异常的肿瘤患者提供新的治疗选择。该产品已经已有7个适应症被NMPA药品审评中心(CDE)纳入突破性治疗品种,涉及瘤种包括乳腺癌、NSCLC、结直肠癌、胃癌、胆道癌以及卵巢癌。

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 40
40

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 39
39

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 40
40