 产业资讯
产业资讯
 药渡
药渡  2025-05-30
2025-05-30
 925
925
2025年5月24日,生物制药企业百奥泰宣布,其自主研发的乌司奴单抗生物类似药STARJEMZA®(BAT2206)正式获得美国食品药品监督管理局(FDA)上市批准。
该药物获批适应症覆盖成人及儿童中重度斑块状银屑病(PsO)、活动性银屑病关节炎(PsA);成人中重度活动性克罗恩病(CD)和中重度活动性溃疡性结肠炎(UC)。成为百奥泰继托珠单抗、贝伐珠单抗之后,第三个成功打入美国市场的生物类似药。

图1. BAT2206获FDA上市批准,来源:百奥泰公告
01
作用机制及获批依据
乌司奴单抗(Ustekinumab)是一种靶向白细胞介素IL-12和IL-23共有p40亚基的全人源单克隆抗体。IL-12和IL-23是天然产生的细胞因子,参与炎症和免疫应答过程。乌司奴单抗通过与p40亚基以高亲和力特异性结合,阻断其与细胞表面受体的结合,从而破坏IL-12和IL-23介导的信号传导和细胞因子的效应。
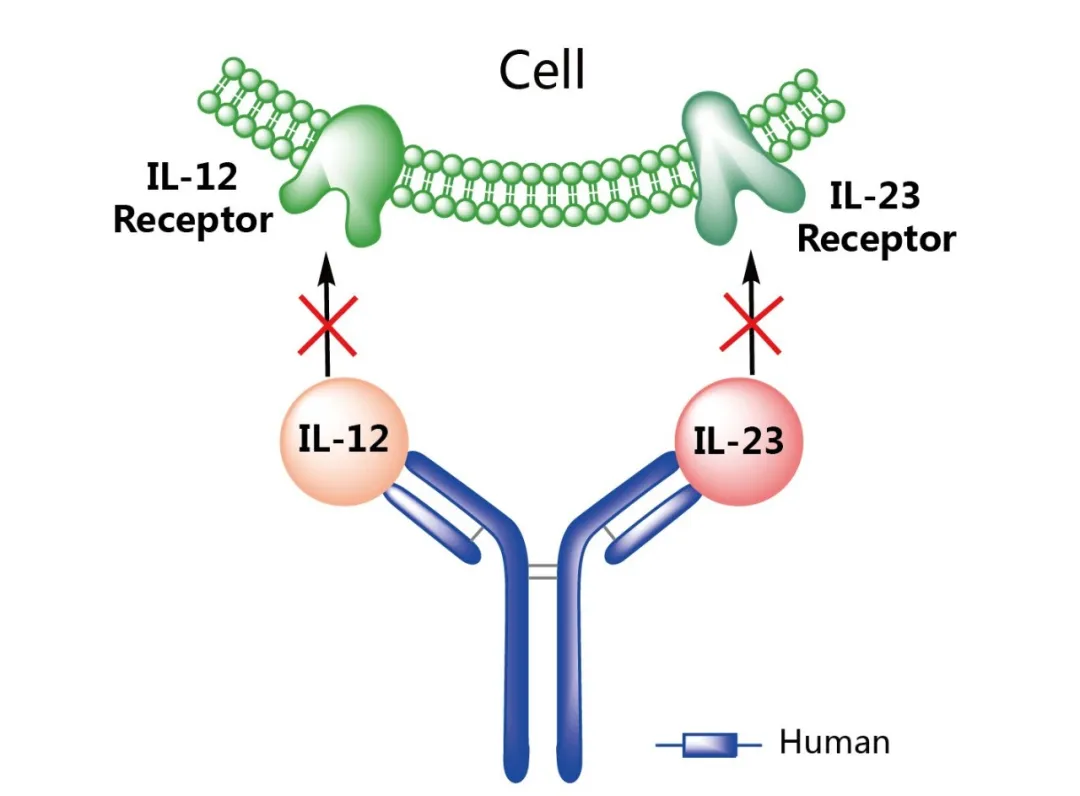
图2. 乌司奴单抗作用机制示意图,来源:药渡数据-全球药物库
BAT2206此次获批基于百奥泰提交的全面分析结果、临床前及临床数据。在临床研究方面,百奥泰对STARJEMZA®的结构、物理化学和生物学特征进行了广泛的分析与表征研究,证明了其与原研药的高度相似性。
I期临床研究在健康受试者中评估了STARJEMZA®与原研药的药代动力学特征、安全性和免疫原性,结果显示一致性。
III期临床研究进一步证实了其与原研药在安全性、有效性和免疫原性上的高度相似性。
这些研究结果为STARJEMZA®的获批提供了坚实的临床依据。
02
乌司奴单抗市场格局
乌司奴单抗的原研药Stelara®由强生开发,成为全球首款获批的IL-12/23抑制剂,累计获批用于斑块状银屑病、银屑病关节炎、克罗恩病、溃疡性结肠炎等多个适应症。

图3. 强生乌司奴单抗2011-2024年销量数据,来源:药渡数据-全球药物库
2023年,乌司奴单抗为强生创下了108.58亿美元的销售额,同比增长11.7%,首次突破百亿美元大关,稳居自免领域“药王”宝座。然而,由于其美国专利在2023年9月到期,乌司奴单抗原研药的市场被多家生物类似药企业瓜分,2024年销售额出现下滑,为103.6亿美元。
随着Stelara®核心专利的到期,美国生物类似药市场竞争激烈。安进率先推出类似药,但因强生诉讼一度受阻。2023年11月,安进的Wezlana成为首个获批FDA的乌司奴单抗生物类似物。截至2025年5月,美国市场已批准7款乌司奴单抗生物类似药,包括安进(Amjevita®)、三星生物(Pyzchiva®)、山德士(Pyzchiva®)、梯瓦(Ustekinumab-ttwe)等企业的药物。
在中国,2024年10月华东医药与荃信生物合作开发的乌司奴单抗生物类似药——赛乐信®获得NMPA批准上市,用于治疗成年中重度斑块状银屑病。这标志着国内首个乌司奴单抗生物类似药正式进入市场。百奥泰的BAT2206在2023年11月宣布达到3期主要终点,并于近日获得FDA批准,并同步向中国NMPA、欧洲EMA提交上市申请。
03
挑战与机遇并存
此次获批,需要直面众多同类竞品的市场挑战,但也存在诸多机遇,可谓是生物类似药的“冰与火之歌”。
01“冰之歌”——挑战
激烈市场竞争激烈市场竞争:尽管市场潜力巨大,但乌司奴单抗生物类似药市场竞争激烈。已有多款生物类似药获批上市,且后续还有更多产品处于研发和申报阶段。百奥泰的STARJEMZA®需要在产品质量、价格、品牌推广等方面不断提升竞争力,才能在市场中脱颖而出。价格压力:生物类似药通常会面临价格下降的压力。为了在市场中获得竞争优势,STARJEMZA®可能需要降低价格,这将对百奥泰的利润空间产生一定影响。
研发与生产要求:生物类似药的研发和生产需要严格的质量控制和监管。百奥泰需要持续投入资源,确保STARJEMZA®的质量和安全性,以满足不同国家和地区的监管要求。
02“火之歌”——机遇
市场潜力巨大:乌司奴单抗原研药的全球销售额高达百亿美元,其生物类似药市场前景广阔。百奥泰的STARJEMZA®作为新获批的生物类似药,有望在这一庞大的市场中占据一定份额,为公司带来可观的收益。
FDA政策转变:2024年6月,FDA发布更新版指南,不再强行要求生物类似药做“可转换”研究。这一政策转变降低了生物类似药的上市门槛,加快了其上市进程,为百奥泰的其他生物类似药产品在美国市场的推广提供了便利。
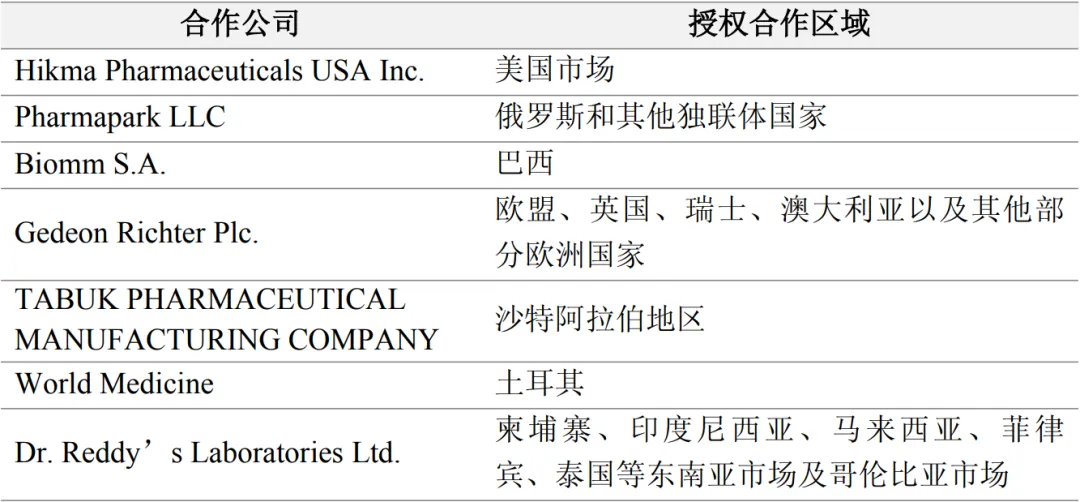
国际合作助力:百奥泰与Hikma Pharmaceuticals的合作,使得STARJEMZA®能够借助Hikma在美国的商业网络迅速推向市场。这种合作模式不仅有助于提高产品的市场覆盖率,还能为百奥泰带来稳定的收益。不仅如此,BAT2206已与Gedeon Richter(欧盟)、Tabuk(中东)、Biomm(巴西)、Dr. Reddy’s(东南亚与哥伦比亚)等合作,布局覆盖欧美+新兴市场,通过国际合作来加快全球市场化步伐。
表1. 百奥泰BAT2206国际授权合作情况,来源:百奥泰公告
多款类似药集中上市将加剧价格竞争,可能显著降低原研药市场份额,百奥泰等企业需通过差异化策略(如授权合作、适应症拓展)应对竞争。中国生物类似药市场规模持续增长,百奥泰乌司奴单抗类似药在国内的申报未来可能成为新增长点。原研药已覆盖银屑病、克罗恩病等,类似药若扩展至更多免疫疾病领域,将进一步扩大市场。
结 语
百奥泰乌司奴单抗生物类似药STARJEMZA®获得美国FDA上市批准,是百奥泰发展历程中的又一重大里程碑。这一成就不仅体现了百奥泰在生物制药领域的研发实力,也为公司未来的国际化发展奠定了坚实的基础。
然而,面对激烈的市场竞争和诸多挑战,百奥泰需要不断提升自身的核心竞争力,加强研发创新,优化生产流程,提高产品质量和服务水平。只有这样,百奥泰才能在生物类似药市场中占据一席之地,为全球患者提供更优质、更可负担的治疗选择。

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 41
41

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 40
40

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 40
40