 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-05-31
2025-05-31
 1148
1148
III 期临床启动,意味着新药研发已经开始向上市申请发起冲刺。
Insight 数据库显示,2025 年 5 月(数据范围 5.1-5.29),多款国产创新药启动关键 III 期临床,涉及 BTK、HER2、PD-1、GLP-1 等一些明星靶点。
其中,恒瑞启动 GLP-1/GIP 双受体激动剂用于阻塞性睡眠呼吸暂停(使用气道正压通气治疗)合并肥胖关键 III 期,百济神州、正大天晴、三生制药分别启动 BTK 降解剂、HER2 双抗 ADC、PD-1/VEGF 双抗头对头 III 期临床...本文从中选择部分重点项目跟大家分享。*由于文章篇幅有限,难以纳入所有关键临床。欢迎使用 Insight 数据库「全球临床试验」模块进行查阅(长按文末二维码即可免费试用哦~)
百济神州 Catadegbrutinib
启动头对头匹妥布替尼 III 期临床
5 月 7 日,百济神州启动一项 III 期开放标签随机研究,旨在评估 Catadegbrutinib(BGB-16673)与匹妥布替尼相比在复发/难治性慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)患者中的安全性和有效性。研究拟纳入 500 人,主要终点是 PFS。

截图来源:Insight 数据库
BGB-16673 是一种口服、靶向 BTK 的在研嵌合式降解激活化合物(CDAC),同时也是百济神州 CDAC
平台首款在研药物。此前,百济神州还启动了一项 BGB-16673 的国际多中心 III 期研究,旨在既往接受过共价 BTK 抑制剂的复发/难治性 CLL/SLL
患者中比较 BGB-16673 与研究者选择的治疗的效果和安全性。
在 2024 年美国血液学会(ASH)年会上,百济神州以口头报告的形式公布 BTK 降解剂 BGB-16673 的 I 期临床研究 CaDAnCe-101 (BGB-16673-101; NCT05006716) 的数据。这是一项正在全球多个国家进行的开放标签、首次人体试验的 I/II 期研究,旨在评估 BGB-16673 单药治疗一系列 B 细胞恶性肿瘤患者的效果。
截至 2024 年 5 月 24 日,共有 49 名 CLL 患者入组并接受治疗。中位随访时间为 4.3 个月,在 49 例可评估疗效的患者中,ORR 为 78%,CR/CRi 为 4%。其中 200 mg 剂量组的 ORR 为 94%,包括 2 例 CR。首次缓解的中位时间为 2.8 个月。17 名患者持续治疗≥ 9 个月,所有 17 名患者均持续缓解。
三生制药 SSGJ-707
启动首个 III 期临床
5 月 12 日,三生制药在国内启动一项随机、对照、双盲 III 期临床研究,旨在评价 SSGJ-707 对比帕博利珠单抗一线治疗 PD-L1 阳性的局部晚期或转移性非小细胞肺癌的有效性。研究拟纳入 420 人,主要终点指标是由独立影像评估委员会(IRRC)基于 RECIST v1.1 评估的 PFS。

截图来源:Insight 数据库
SSGJ-707 是三生制药基于专有的 CLF2 专利平台开发的一款靶向 PD-1/VEGF 的双特异性抗体,与国内其他同靶点产品结构不同,SSGJ-707 采用天然 IgG4 结构的分子,无 ADCC 和 CDC 效应。
5 月 20 日,三生制药将该药在全球(不包括中国内地)的开发、生产、商业化权利独家授予辉瑞,总金额高达 60.5 亿美元,其中首付款就有 12.5 亿美元,创中国创新药出海新记录。在 2025 年 ASCO 大会上,三生制药公布了 SSGJ-707 作为晚期 NSCLC 患者单一疗法的 II 期临床(SSGJ-707-NSCLC-II-01,NCT06361927)的最新研究数据。结果显示,SSGJ-707 单药疗法在初治晚期 NSCLC 中显示出良好的疗效,且安全性可控。在 10 mg/kg Q3W 剂量方案治疗中,25 例患者至少完成两次疗效评估,ORR 为 72%,DCR 高达 100%。
明慧医药 MHB018A
启动首个 III 期临床
5 月 19 日,明慧医药启动了一项 III 期随机、双盲、安慰剂对照研究,旨在评估 MHB018A 注射剂对活动性中度至重度甲状腺眼病(TED)患者的疗效。该试验拟纳入 108 人,主要终点是第 24 周时的突眼反应率。

截图来源:Insight 数据库
MHB018A 是一种新型皮下注射 VHH-Fc 融合蛋白,靶向胰岛素样生长因子-1 受体(IGF-1R),该受体已被证实具有治疗 TED 的作用机制。2024 年 10 月,明慧医药宣布皮下注射 MHB018A 在活动性中度至重度 TED 患者中的 Ib/II 期临床(CTR20232542)取得积极结果。数据显示,在第 12 周时,300 mg 组、600 mg+300 mg 组和 450 mg组的眼球突出缓解率(与基线相比,眼球突出减少 ≥2 毫米的参与者百分比)分别为 50.0%、50.0% 和 87.5%,而安慰剂组仅为 16.7%。450 mg 组表现出快速、显著且持续的缓解,在第 4 周和第 8 周,分别有 50.0% 和 87.5% 的患者眼球突出减少 ≥2 毫米。
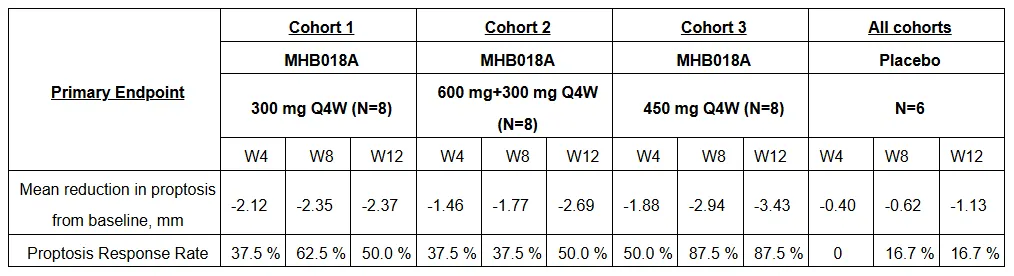
截图来源:企业官网
临床益处通过其他疗效终点得到进一步证明,包括总体反应率,定义为研究眼中眼球突出度从基线减少 ≥2 毫米且临床活动评分 (CAS) 提高 ≥2 分的受试者比例,以及达到 CAS 0 或 1 的受试者百分比。与安慰剂相比,MHB018A 在所有这些参数上均表现出显著改善。
在安全性方面,MHB018A 在所有剂量方案中均具有良好的耐受性。大多数不良事件严重程度为 1 级或 2 级,并在完成治疗后无需干预即可缓解。未报告严重听力障碍。其总体安全性与其他 IGF-1R 抗体一致。
Insight 数据库显示,在 IGF-1R 单抗领域,全球仅有 2 款药物获批,首款获批上市的是安进的替妥木单抗,24 年全球销售额达 18.51 亿美元。第二款是信达的 IBI311,于 25 年 3 月首次在国内获批上市。

截图来源:Insight 数据库
正大天晴 TQB2102
启动头对头恩美曲妥珠单抗 III 期临床
5 月 15 日,正大天晴在国内启动了一项随机、开放、平行对照的 III 期临床试验,旨在评价注射用 TQB2102 对比注射用恩美曲妥珠单抗在 HER2 阳性晚期乳腺癌中的有效性和安全性。该试验纳入 246 名受试者,主要终点是 IRC 评估的 PFS。

截图来源:Insight 数据库
TQB2102 是正大天晴自主开发的一款 HER2 双抗 ADC,此前 2024 年 8 月在国内启动了评价 TQB2102 对比研究者选择的化疗在 HR 阳性、HER2 低表达复发/转移性乳腺癌中有效性和安全性的 III 期临床。本次是该药启动的第 2 项 III 期。
Insight 数据库显示,目前全球范围内共有 6 款 HER2 双抗 ADC 在研(仅统计积极状态),正大天晴 TQB2102 和康宁杰瑞 Anbenitamab repodatecan( JSKN-003)进展最快,已进入 III 期临床。正大天晴在 2024 年业绩报告中披露,TQB2102 有望在 2027 年上市。

截图来源:Insight 数据库

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 41
41

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 40
40

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 40
40