 产业资讯
产业资讯
 药创新
药创新  2025-06-05
2025-06-05
 2242
2242
9项研究入选ASCO口头报告
安罗替尼是一款小分子多靶点酪氨酸激酶抑制剂,其核心作用机制在于通过对VEGFR、FGFR、PDGFR等多重靶点的抑制,实现对肿瘤血管生成的阻断及肿瘤细胞增殖的抑制。
截至目前,安罗替尼已在国内获批8项适应证,覆盖非小细胞肺癌、软组织肉瘤、小细胞肺癌、甲状腺髓样癌、甲状腺分化癌等多个领域。另有联合化疗用于一线晚期不可切除或转移性软组织肉瘤等新适应证处于新药上市申请(NDA)审评阶段。此外,安罗替尼还有多项新适应证的临床研究正在III期,包含一线非鳞状非小细胞肺癌、一线结直肠癌等。
在2025年ASCO大会上,中国生物制药以12项口头报告展示创新实力,其中安罗替尼相关研究占9项,成为国产创新药中入选口头报告数量最多的单药。
➤在脑胶质瘤领域,成为首个成功的小分子口服抗血管生成药物联合方案
胶质母细胞瘤(GBM)一线治疗标准方案STUPP(手术+放疗+替莫唑胺化疗)虽可短期控制病情,但几乎所有患者均会复发,且复发治疗面临高龄患者常被临床试验排除、血脑屏障导致药物递送困难及细胞毒药物剂量毒性平衡等挑战。鉴于血管增生是GBM的显著病理特征,抗血管生成治疗成为重要探索方向。
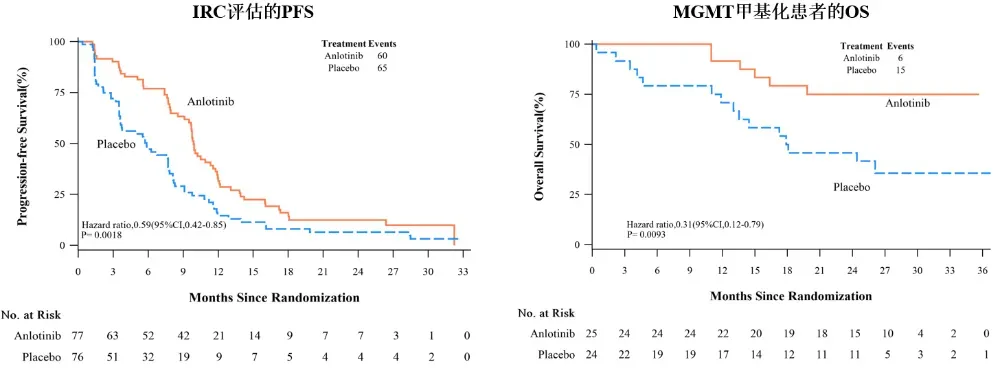
安罗替尼联合STUPP方案对比安慰剂治疗新诊断脑胶质瘤患者的多中心、随机、双盲、安慰剂对照的临床研究结果显示:安罗替尼联合STUPP方案组IRC评估的中位无进展生存期(mPFS)达9.89个月(95% CI 9.10-11.56),较安慰剂组(5.85个月)显著延长,疾病进展或死亡风险降低41%(HR=0.59,p=0.0018)。
值得关注的是,在MGMT甲基化亚组中,安罗替尼组中位总生存期(mOS)虽未达到,但死亡风险已显著降低69%(HR=0.31,p=0.0093)。安全性方面,安罗替尼组主要不良反应为可控的高血压,未出现新的安全性信号,支持长期用药。
图片来源:正大天晴官微
这一突破性结果首次证实,小分子多靶点抗血管生成药物安罗替尼联合标准治疗方案在新诊断GBM中具有协同增效价值,标志着该联合方案成为首个获得成功的小分子口服抗血管生成药物联合治疗模式,为GBM患者带来新的治疗选择。
➤为软组织肉瘤一线治疗开新篇
目前局晚期或转移性软组织肉瘤(STS)的一线治疗仍以蒽环类药物联合异环磷酰胺化疗为主。尽管这类方案应用已逾数十年,但客观缓解率仅15%-18%,且受限于心脏毒性等剂量限制性副作用,全球至今尚无任何联合化疗组合疗法获正式批准用于晚期软组织肉瘤的一线治疗。
2024年10月,中国生物制药基于关键性临床III期研究(ALTN-III-04)的数据支撑,向CDE正式递交了安罗替尼与化疗联合用于晚期不可切除或转移性软组织肉瘤一线治疗适应证的上市申请,并获正式受理。
中国生物制药在2025年ASCO年会上披露了ALTN-III-04研究的数据。初步结果显示,试验组中位无进展生存期(mPFS)较对照组显著延长,为8.57个月vs3.02个月(HR=0.30,95% CI 0.21-0.44,p<0.001);客观缓解率(ORR)提升近6倍,为17.8%vs2.9%;疾病控制率(DCR)显著提高,为79.3%vs54.7%。
尽管总生存期(OS)数据尚未成熟(HR=0.78,95% CI 0.49-1.25),但已呈现出明确的获益趋势。预设的亚组分析(涵盖平滑肌肉瘤、滑膜肉瘤及其他病理亚型)结果显示,各亚组均与试验组整体获益趋势一致。
ALTN-III-04作为全球首个在软组织肉瘤领域验证TKI联合化疗方案疗效的III期临床研究,有望重塑软组织肉瘤一线治疗近数十年临床实践标准,为患者提供全新治疗选择。
安罗替尼作为中国生物制药肿瘤治疗领域的核心战略品种,公司以其为核心构建“抗血管生成+免疫治疗”协同模式,推动安罗替尼与自研PD-1单抗(派安普利单抗)、PD-L1单抗(贝莫苏拜单抗)形成联合治疗体系。
人源化抗PD-L1单克隆抗体贝莫苏拜单抗通过阻断肿瘤细胞PD-L1免疫抑制通路,重启机体抗肿瘤免疫应答;安罗替尼则可抑制VEGFR/PDGFR/FGFR等多重靶点,二者联用兼具抗血管生成与肿瘤微环境调控的双重作用机制。
目前,该联用方案用于治疗广泛期小细胞肺癌、子宫内膜癌、肾细胞癌的适应证已获批上市。针对晚期鳞状非小细胞肺癌(sq-NSCLC)患者一线治疗、Ⅲ期不可切除非小细胞肺癌(NSCLC)患者巩固治疗的上市申请均已获国家药监局受理,另有多个适应证的临床研究正在推进中。
➤与K药头对头
长期以来,帕博利珠单抗(K药)单药是一线治疗PD-L1阳性晚期非小细胞肺癌(NSCLC)的标准方案之一,但其中位无进展生存期(PFS)约6个月,临床仍亟需更优解。
贝莫苏拜单抗联合安罗替尼对比帕博利珠单抗一线治疗晚期NSCLC的临床III期CAMPASS研究(全球首个抗PD-L1单抗联合多靶点抗血管TKI一线治疗PD-L1阳性NSCLC的III期临床研究)结果显示:
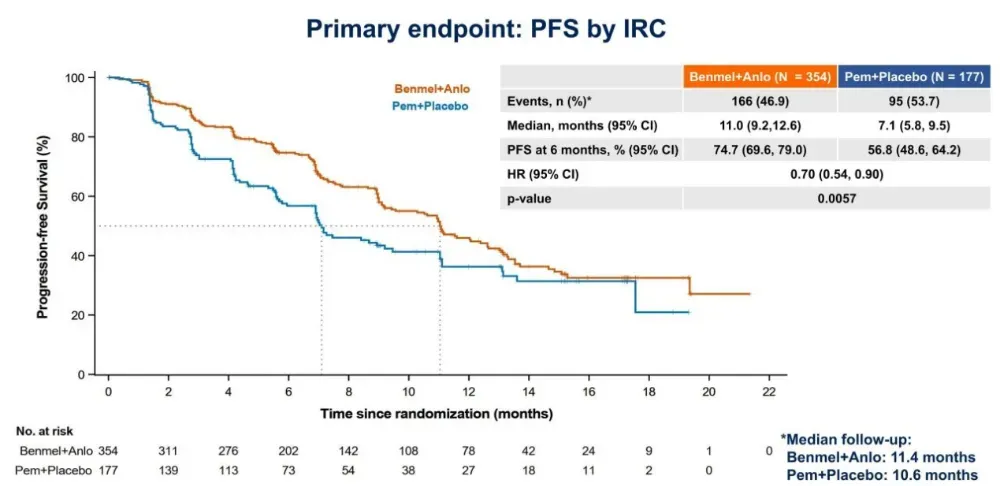
在全人群中,中位PFS达到11.0个月,较帕博利珠单抗治疗延长3.9个月,疾病进展或死亡风险降低30%(HR=0.70)。
几乎所有预设亚组均可从联合方案中获益,尤其在PD-L1高表达(TPS≥50%)人群中,中位PFS延长6.1个月,疾病进展/死亡风险降低40%(HR=0.60)。结合临床实践中更倾向给TPS≥50%患者使用无化疗方案,凸显了本研究巨大的临床价值。
客观缓解率(ORR)为57.3%(vs 39.5%),疾病控制率(DCR)达85.9%(vs 79.1%),均实现统计学显著提升。
图片来源:正大天晴官微
➤针对III期NSCLC,中位PFS突破15个月
贝莫苏拜单抗联合或不联合安罗替尼用于同步/序贯放化疗后未进展的局部晚期、不可切除(III期)NSCLC巩固治疗的III期临床R-ALPS研究共完成了553例患者的随机入组,试验组1(209例)接受贝莫苏拜单抗联合安罗替尼治疗、试验组2(212例)为贝莫苏拜单抗联合安慰剂治疗、对照组(132例)仅接受安慰剂治疗。结果显示:
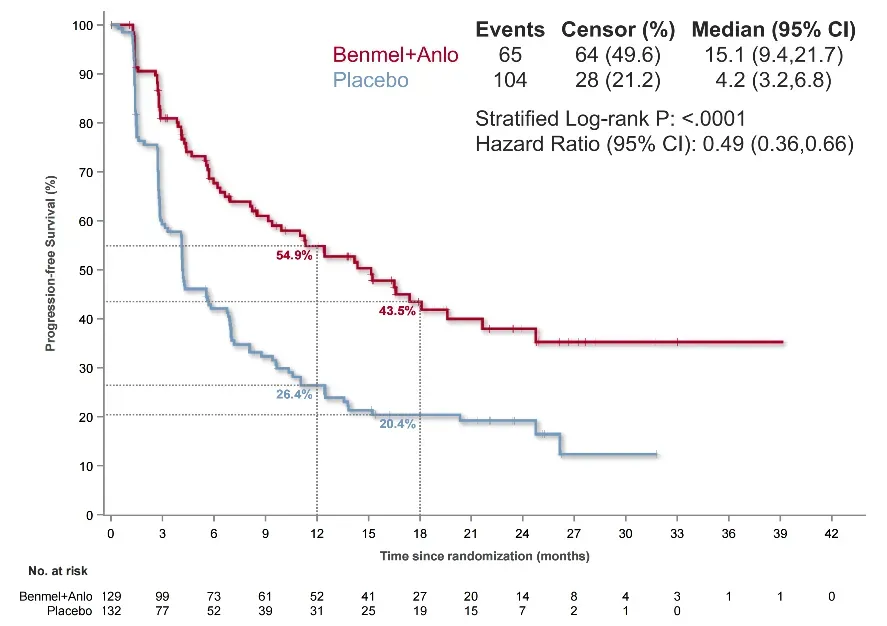
试验组1的中位PFS达到了15.1个月,与对照组的4.2个月相比,疾病进展或死亡风险大幅降低了51%(HR=0.49,95%CI 0.36-0.66,p<0.001)。试验组2的中位PFS为9.7个月,显著优于对照组的4.2个月,疾病进展或死亡风险降低了47%(HR=0.53,95% CI 0.39-0.72,p<0.0001)。
预设的亚组分析涵盖了是否吸烟、前序治疗方式为同步或序贯等不同因素,结果显示各试验组获益趋势一致。
图片来源:正大天晴官微
基于R-ALPS研究的优异结果,贝莫苏拜单抗联合或不联合安罗替尼的新适应证上市申请已于2025年4月获CDE受理。这标志着局部晚期NSCLC的维持治疗从单纯依赖免疫激活的阶段,正式跨入“血管重塑-免疫协同”的全新纪元,为该类患者的治疗提供了更具潜力的新选择。
另外,派安普利单抗与安罗替尼的联合方案已在三阴乳腺癌、非小细胞肺癌、肝细胞癌等实体瘤开展多项临床试验,其中该联用方案一线治疗晚期肝细胞癌的上市申请已于2024年11月获国家药监局受理。
安罗替尼自2018年上市以来,凭借丰富的适应证布局与创新联合治疗模式,持续释放市场潜力,稳居抗肿瘤药物第一梯队。随着多个新适应证上市申请的陆续获批,以及联合疗法在一线治疗领域渗透率的进一步提升,安罗替尼的市场增长潜力有望得到更充分释放。
中国生物制药肿瘤创新药矩阵加速扩容
中国生物制药2024年全年营收达288.7亿元。其中,肿瘤板块收入表现亮眼,达到107.3亿元,较上一年同期增长22%,在集团总收入中的占比约为37.2%,成为推动公司发展的重要力量。在研发投入上,中国生物制药2024年研发投入费用达50.9亿元,占总收入的比例为17.6%。
据中国生物制药2024年年报显示,在肿瘤领域公司拥有36个处于临床及以上开发阶段的创新药候选药物,包括3个处于上市申请阶段,8个处于临床III期或注册临床阶段、11个处于临床II期、14个产品处于临床I期。此外,还有14个肿瘤领域的生物类似药或仿制药候选药物处于临床及以上开发阶段。公司预计,在未来三年(2025-2027年),肿瘤领域将有6个创新药和8个生物类似药或仿制药获批上市,为公司持续注入新的产品活力。
在肿瘤领域,帕托珠单抗、贝伐珠单抗、贝莫苏拜单抗、亿立舒等产品是重要的增长引擎。2024年,KRAS抑制剂和ALK抑制剂相继上市,为公司在肿瘤治疗市场打开新的局面。而CDK2/4/6抑制剂有望于2025年获批,这些产品的陆续推出和市场拓展,预计将为公司带来可观的收入增长,进一步巩固其在肿瘤创新药领域的地位。

 产业资讯
产业资讯
 智药局
智药局  2025-12-15
2025-12-15
 86
86

 产业资讯
产业资讯
 Medaverse
Medaverse  2025-12-15
2025-12-15
 75
75

 产业资讯
产业资讯
 生物药大时代
生物药大时代  2025-12-15
2025-12-15
 67
67