 产业资讯
产业资讯
 Insight数据库
Insight数据库  2025-06-10
2025-06-10
 604
604
提起 Claudin(CLDN)家族,大家可能会首先想到已被药企扎堆狂卷的火热靶点 CLDN18.2。实际上,在一众药企追捧 CLDN18.2 的时候,一些药企已另辟蹊径,瞄上了 CLDN 家族的另一潜力靶点——CLDN6 。
近期,百济神州在国内启动其 CLDN6×CD3 双抗的临床研究,齐鲁制药也启动了其 CLDN6 ADC 的临床试验。Insight 数据库显示,全球已有十多款 CLDN6 在研管线进入临床,又一个抗肿瘤药物潜力靶点正在悄然出现。
CLDN6 :实体瘤高价值靶点
CLDN 是一类紧密连接蛋白,主要在上皮细胞和内皮细胞中表达。目前已发现 27 个 CLDN 家族成员,其中 24 个在哺乳动物中有表达。根据不同 CLDN 的序列同源性水平,这些成员可分为经典 CLDN 和非经典 CLDN 两类。经典 CLDN 成员包括 1-10、14、15、17 和 19,而非经典 CLDN 成员包括 11-13、16、18 和 20-24。
CLDN 家族成员广泛分布于不同的组织和器官中。研究发现,CLDN 的异常表达与许多肿瘤的发生和发展密切相关,而且其在正常组织和癌症组织中的表达具有明显的差异化,这一特性使它们成为抗肿瘤药物的理想靶点。
CLDN 家族的明星成员 CLDN 18.2 已率先在实体瘤的药物开发中取得成功。2024 年,全球首个 CLDN 18.2 靶向药物佐妥昔单抗(安斯泰来)在日本、欧盟、美国、中国相继获批,联合化疗用于胃癌或胃食管结合部(GEJ)腺癌一线治疗,开辟了 CLDN 家族在癌症治疗中的先河。
CLDN 18.2 之后,CLDN6 是该家族另一被寄予厚望的潜力靶点。CLDN6 是构成细胞间紧密连接的重要分子,在细胞连接和上皮组织通透性中发挥重要作用。
CLDN6 和 CLDN18.2 的表达具有明显的不同。例如,在正常组织中, CLDN18.2 主要在胃粘膜上皮细胞中表达,而CLDN6 主要在胚胎组织中表达。在癌细胞中,CLDN18.2 在胃癌、胃食管结合部腺癌等消化系统肿瘤中高表达,而 CLDN6 主要在子宫内膜癌、宫颈癌、卵巢癌、睾丸癌等中表达上调。
尤为一提的是,与其它 CLDN 家族成员不同,CLDN6 是一种肿瘤特异性蛋白,在健康成人组织中几乎不表达。因此,其被视为实体瘤领域的下一个重要高价值靶点。
全球管线超 30 款,14 款已进入临床
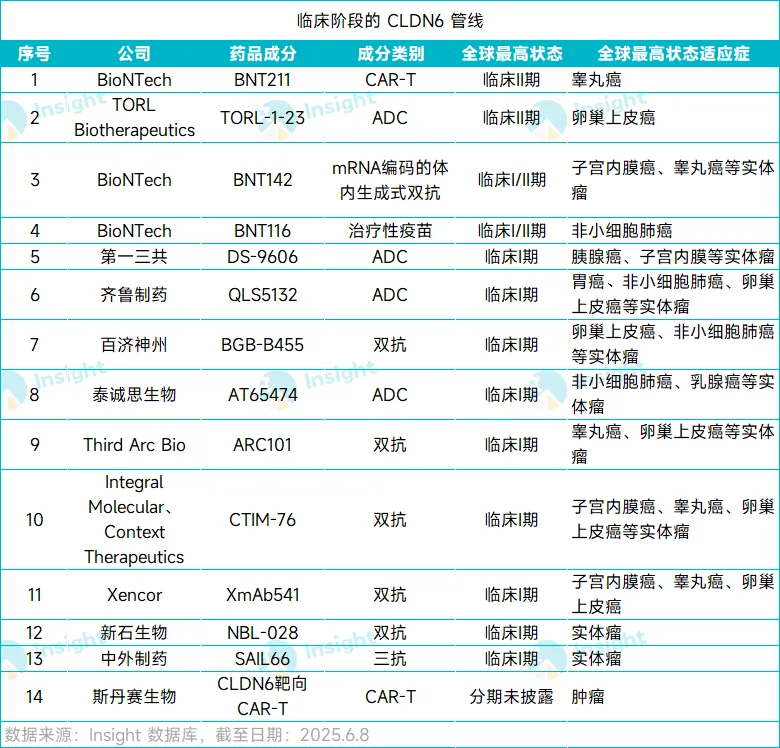
根据 Insight 数据库,全球正在开发中的 CLDN6 管线有 33 款(仅统计活跃状态,截至 2025/6/6), 其中有 14 款已进入临床阶段。
和 CLDN18.2 管线类似,CLDN6 的药物类型也很多样化,单抗、双抗、三抗、ADC、CAR-T、mRNA 药物、疫苗等,应有尽有。下文将挑选几款已有临床数据公布的代表性药物进行介绍。
CLDN6 管线成分类别分布
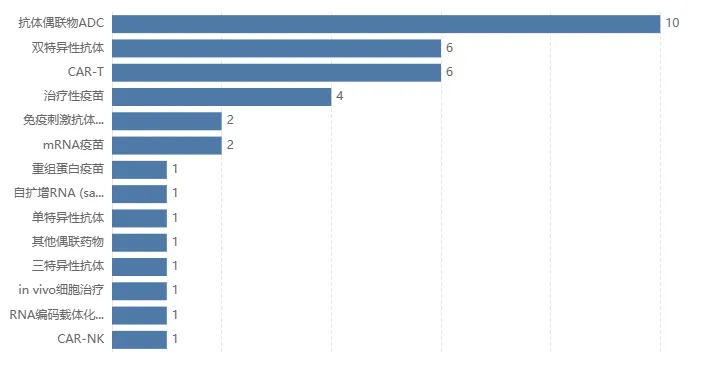
截图来源:Insight 数据库
新型 CAR-T
BioNTech 的 BNT211 是全球进度最快的 CLDN6 CAR-T 疗法,目前正在 Ⅱ 期阶段。值得注意的是,与常规 CAR-T 不同,BNT211 是一款新型的 CAR-T ,它的组分中还包括编码 CLDN6 的 CAR-T 细胞扩增的 mRNA 疫苗(CARVac),用以维持 CLDN6 CAR-T 细胞在体内的扩增能力、持久性和有效性。
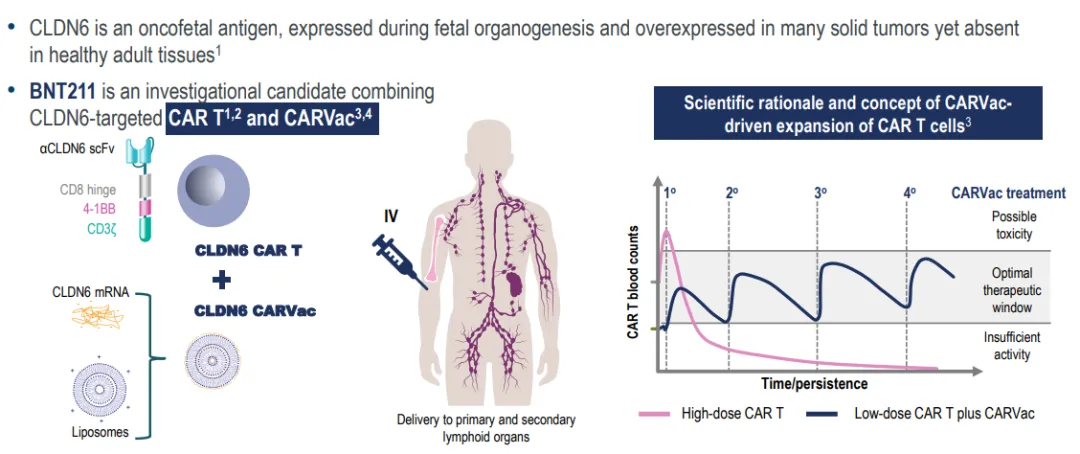
截图来源:2024 ESMO
BioNTech 正在开展两项 BNT211 的临床试验:一项是开放 II 期临床(NCT06940804),旨在评估 CLDN6 CAR-T 联合或不联合 CARVac 在复发或难治性 Claudin 6 阳性睾丸或性腺外生殖细胞肿瘤男性患者中的抗肿瘤活性和安全性;另一项是Ⅰ/Ⅱ期临床(NCT04503278),以评估 CLDN6 CAR-T 联合或不联合 CARVac 治疗 CLDN6 阳性复发或难治性晚期实体瘤患者的安全性和初步疗效。
2024 年 ESMO 大会上公布的 Ⅰ 期临床数据显示,BNT211 ± CARVac 治疗 CLDN6 阳性实体瘤患者整体显示出治疗相关的安全性信号和良好的抗肿瘤活性。截至 2024 年 1 月 8 日,59 名患者接受治疗,ORR 为 38% (20/52),DCR 为 69% (36/52);52 名患者(88%)发生了治疗相关不良事件(TRAE),38 例(64%)患者出现 3 级以上 TRAE。
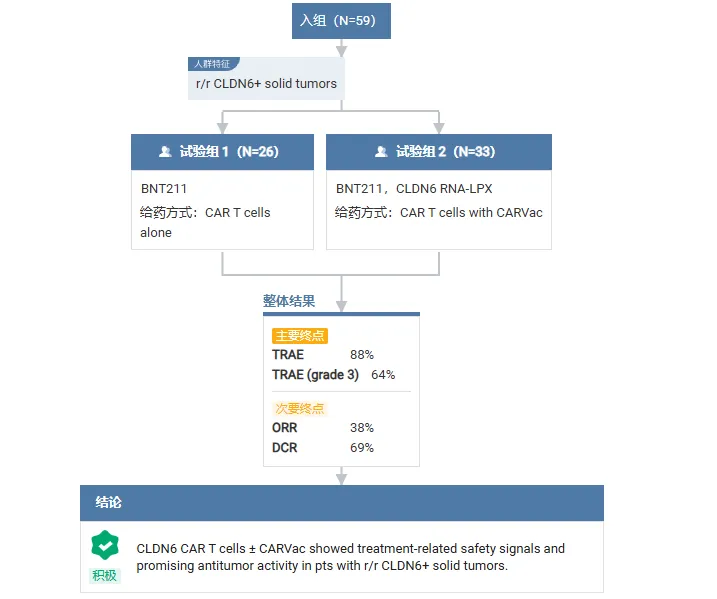
截图来源:Insight 数据库
体内生成式双抗
BioNTech 的 BNT142 是一种新型的脂质纳米颗粒 (LNP) 递送的 mRNA 药物,其是全球首个通过 mRNA 技术实现体内生成双抗的在研药物。
BNT142 RNA-LNP 静脉注射后会在体内被肝细胞吸收,并翻译成 CLDN6×CD3 双抗 RiboMab02.1 。RiboMab02.1 具有两个 CLDN6 靶向片段和一个 CD3 靶向片段, 可通过同时与 CLDN6 阳性肿瘤和 T 细胞结合,进而诱导肿瘤细胞杀伤。
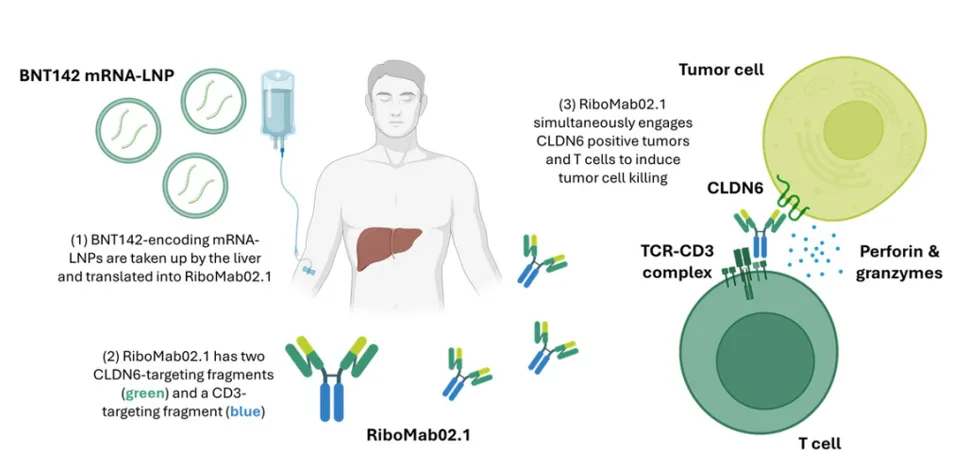
截图来源:2025 ASCO
BNT142 正在 CLDN6 阳性晚期实体瘤患者中开展 I/IIa 期(NCT05262530)剂量递增及扩展队列试验。2025 年 ASCO 上,BioNTech 公布了该药的首次人体临床试验结果。截至 2024 年 12 月 2 日,65 名患者接受治疗:
在所有剂量组中 ORR 为 11.5%(7/61),疾病控制率 (DCR) 为 57.4%,剂量越高,疗效越显著。在卵巢癌患者中,有 7 例达到部分缓解 (PR),DCR 为 76.2%。
安全性方面,41 名(63%)患者发生了多为轻度至中度的治疗相关不良事件 (TRAE),其中 15 名(23%)患者出现 ≥3 级 TRAE;2 例(3%)患者出现剂量限制性毒性。
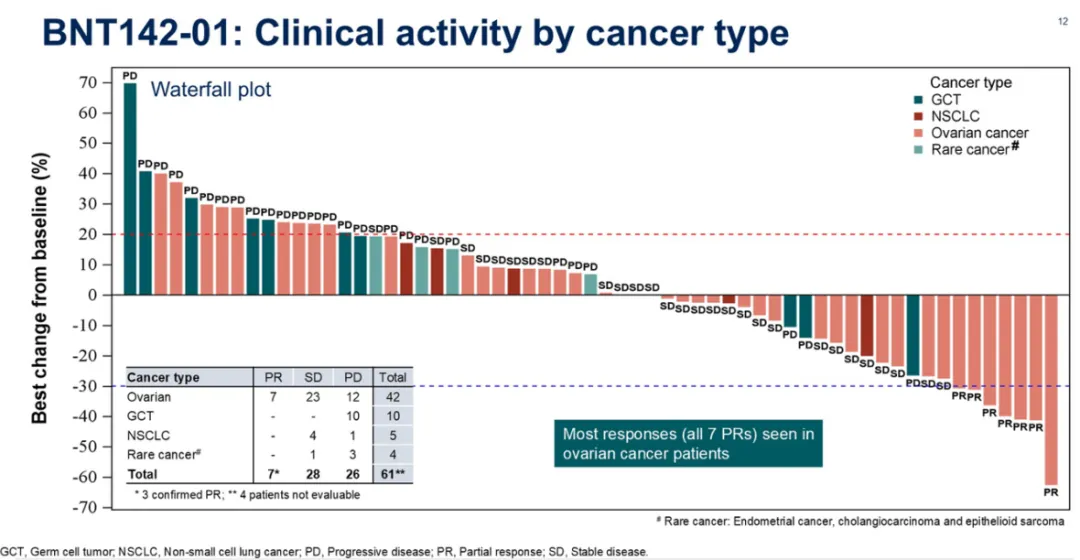
截图来源:2025 ASCO
总体来看,BNT142 在较高剂量范围下表现出可控的安全性和初步抗肿瘤活性,该研究也为 mRNA 编码的双特异性抗体提供了首个临床概念验证。
与传统蛋白双抗相比,mRNA 具有快速生产、剂量灵活等优势。不过,体内 mRNA 持续表达虽然延长了双抗的半衰期,也使 CRS 等不良反应等较难控制,需要有一定的「刹车」机制,以便在毒性发生时可以快速终止抗体生成。
ADC
TORL-1-23 是 TORL Biotherapeutics 开发的一款靶向 CLDN6 的 ADC,目前正在 Ⅱ 期阶段。该药是 TORL 公司产品管线中进度最快的产品,也是全球进度最快的 CLDN6 ADC。
2024 年 ESMO 大会上公布的 Ⅰ 期数据显示:每 3 周一次 2.4 mg/kg 和 3.0 mg/kg 剂量给药,在 20 例 CLDN6+铂耐药/难治性卵巢癌患者中,9 例 (45%) 获得了深度且持久的确认缓解,两种剂量水平的中位缓解持续时间均超过 6 个月,而且安全性良好。TORL-1-23 治疗 CLDN6 阳性非小细胞肺癌和其它 CLDN6 阳性癌症的 I 期研究评估正在进行中。
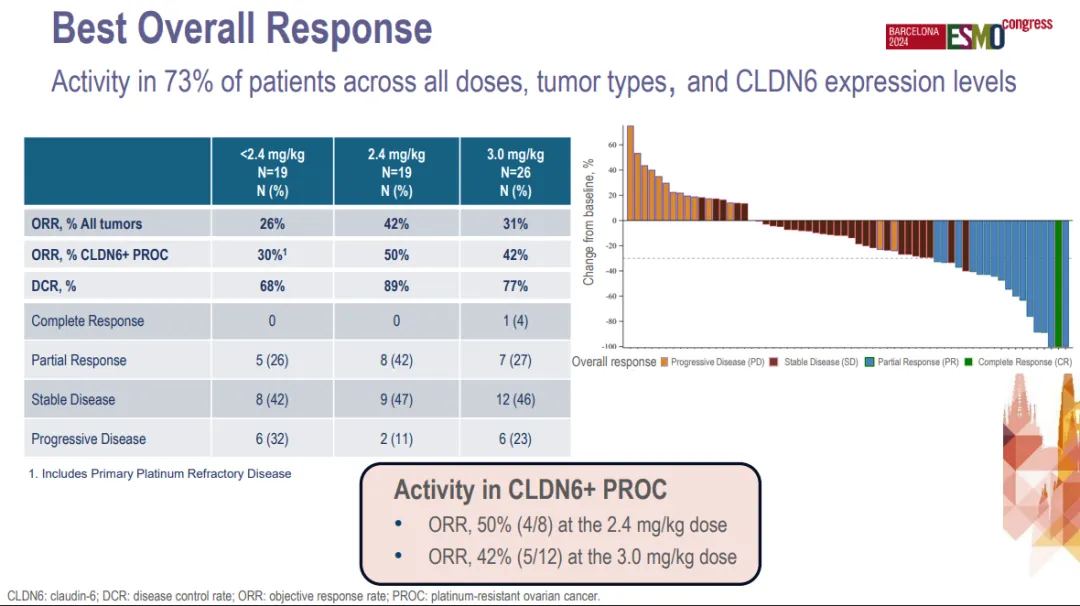
截图来源:2024 ESMO
基于 TORL-1-23 在Ⅰ期临床中表现出的卵巢癌治疗积极结果,2024 年 11 月,TORL Biotherapeutics 已启动一项全球 Ⅱ 期临床研究,以评估 TORL-1-23 治疗 Claudin 6 阳性晚期铂耐药卵巢癌(包括原发性腹膜癌和输卵管癌)女性患者的效果和安全性。
治疗性疫苗
BNT116 是 BioNTech 开发的一款 RNA-脂质体治疗性癌症疫苗,由六种 mRNA(CLDN6、KK-LC-1、MAGE-A3、MAGE-A4、MAGE-C1 和 PRAME)组成,每种 mRNA 都编码一种在 NSCLC 中经常表达的肿瘤相关抗原(TAA)。
2025 年 AACR 大会上公布的 I 期研究(LuCa-MERIT-1)初步数据显示:BNT116 联合西米普利单抗(PD-1)治疗晚期 NSCLC 虚弱患者,ORR 为 45%,SD 为 35%,DCR 为 80%,mPFS 为 9.9 个月,整体安全性可控。
其它产品
除了上述药物,还有 10 款 CLDN6 在研管线进入临床阶段,包括 5 款双抗、1 款三抗、3 款 ADC、1 款 CAR-T,这些产品整体都处于Ⅰ期临床阶段。
其中,第一三共的 DS-9606 是基于其第二个 ADC 平台改良吡咯并苯并二氮杂卓 (PBD) 开发的新型 ADC。24 年 ESMO 上公布的数据显示,该药在表达 CLDN6 的晚期实体瘤患者中初步表现了良好的临床活性。其它药物目前尚未披露临床数据。
小结
在所有开发 CLDN6 靶向药物的公司中,BioNTech 布局最为全面,进度也是全球领先,其开发了三款 CLDN6 管线,包括 CAR-T、疫苗、体内生成式双抗,这三款产品均已进入临床,并获得初步积极结果,进度在各自赛道均排名第一。
国内方面,齐鲁制药、百济神州、泰诚思生物、新石生物、斯丹赛等多家公司也有布局,相关产品都已进入 Ⅰ 期临床阶段,需要等到具体的数据公布后,才能看到真正的效果。
从目前已公布的早期数据来看,CLDN6 靶向药整体表现出了对多种实体瘤的治疗潜力和良好的安全性。希望随着研究的进行,CLDN6 管线领域可以取得更多的进展和突破,为实体瘤患者带来更多的新型选择。

 产业资讯
产业资讯
 创奇健康研究院
创奇健康研究院  2025-11-05
2025-11-05
 19
19

 产业资讯
产业资讯
 21新健康
21新健康  2025-11-05
2025-11-05
 19
19

 产业资讯
产业资讯
 药时代
药时代  2025-11-05
2025-11-05
 20
20