 研发追踪
研发追踪
 星药
星药  2025-06-23
2025-06-23
 2311
2311
6 月 17 日,Immuneering 宣布其正在进行的评估口服每日一次新型 MEK 抑制剂 atebimetinib (IMM-1-104) 联合改良吉西他滨/注射用白蛋白结合型紫杉醇 (mGnP) 治疗一线胰腺癌患者的 2a 期临床试验取得了积极数据。
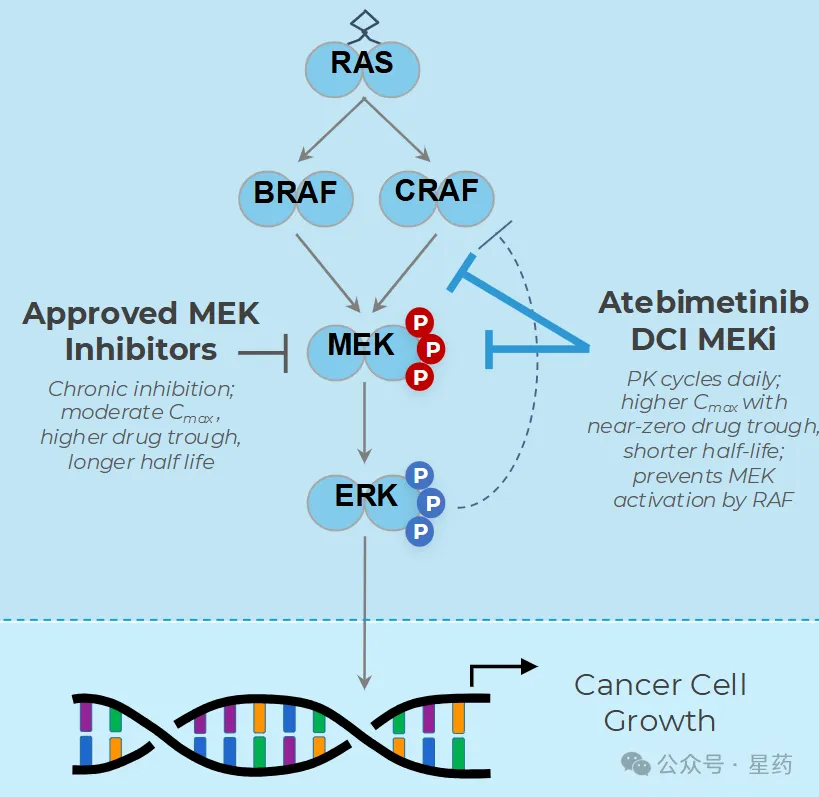
Atebimetinib + mGnP 在 2a 期数据中展现出持久性和耐受性
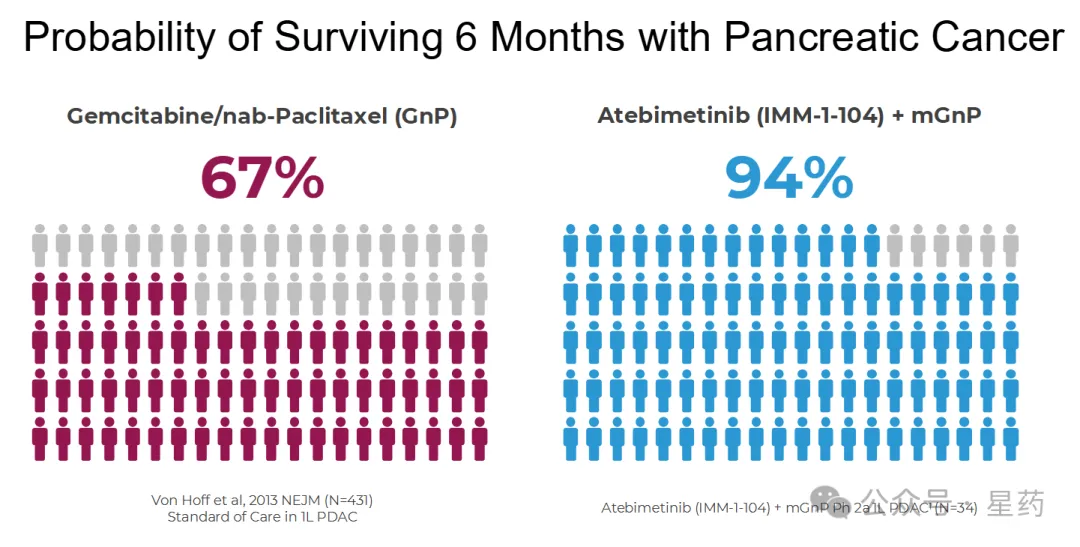
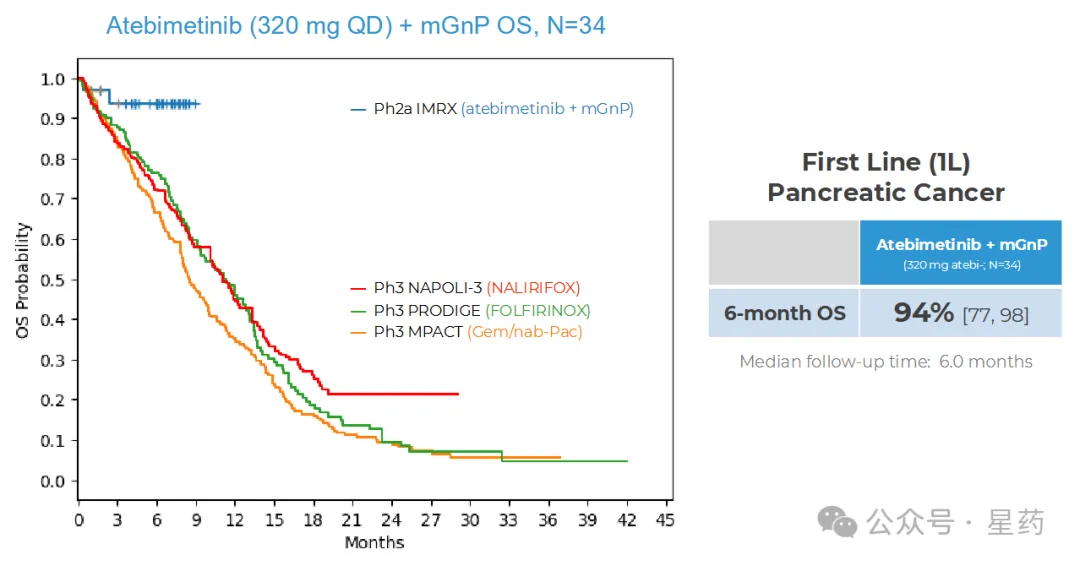
对于接受 atebimetinib(320mg 每日一次)联合 mGnP 治疗的一线(1L)胰腺癌患者(N=34),6 个月总生存率(OS)达到 94%。而标准治疗(全剂量和全疗程 GnP)在该患者群体中的 6 个月 OS 基准为 67%。截至数据截止日期,中位 OS 尚未达到。
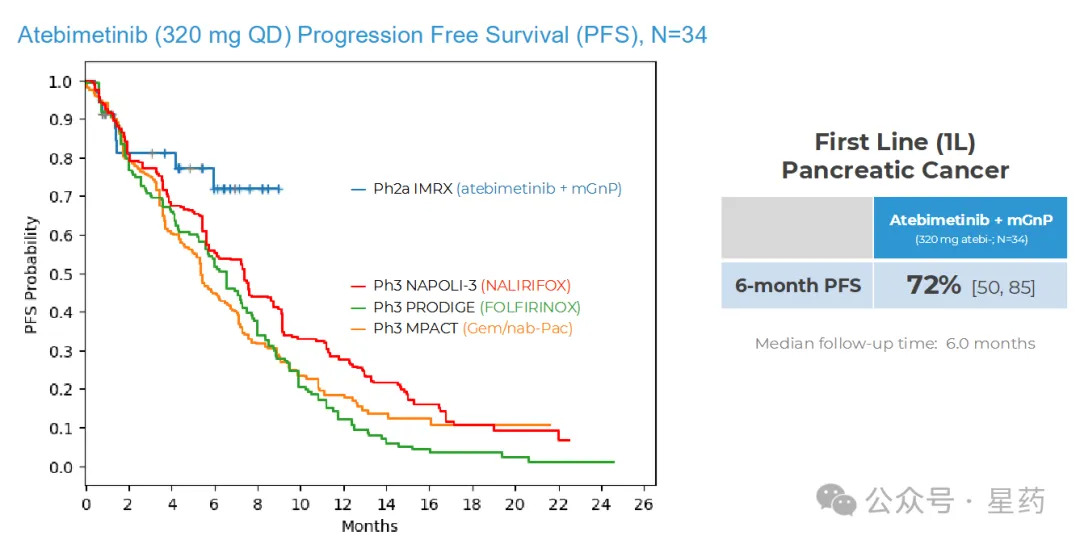
对于接受 atebimetinib(320mg 剂量)联合 mGnP 治疗的一线(1L)胰腺癌患者(N=34),6 个月无进展生存率(PFS)达到
72%。而标准治疗(全剂量和全疗程 GnP)在该患者群体中的 6 个月 PFS 基准为 44%。截至数据截止日期,中位 PFS 尚未达到。
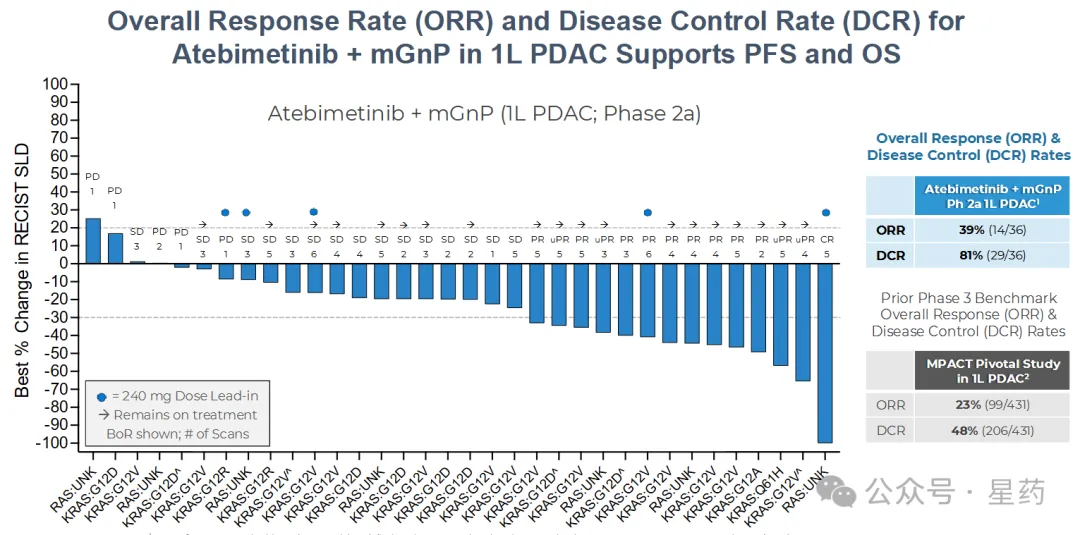
在 atebimetinib + mGnP 的 240mg 和 320mg 剂量水平下,可评估疗效的患者(N=36)观察到 39% 的总缓解率(ORR)和
81% 的疾病控制率(DCR),其中包括许多患者出现深入、持久的消退,以及多个病灶被清除的例子。
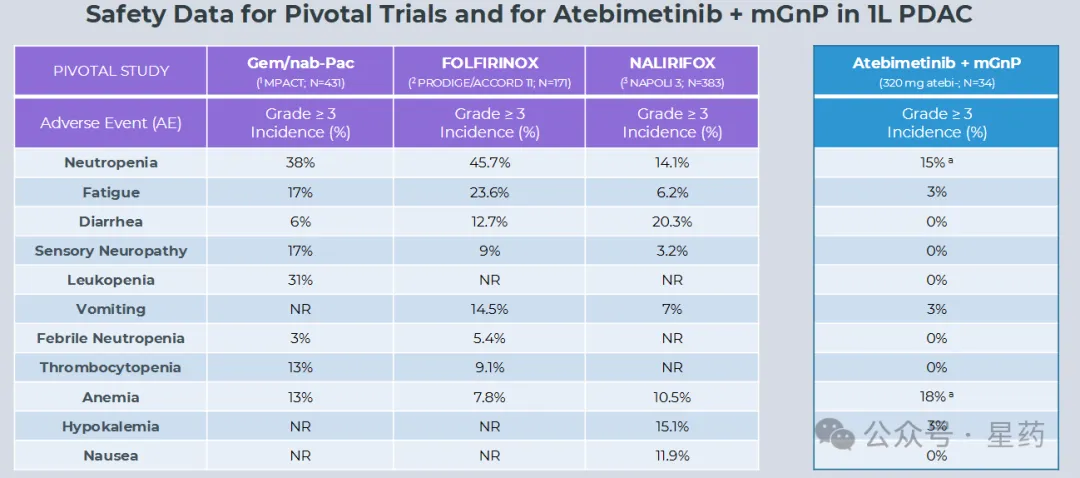
Atebimetinib 联合 mGnP 继续显示出显著的良好耐受性。在一线胰腺癌标准护理化疗中常见的多数不良事件类别中,未观察到 3
级以上事件。
基于这些数据,公司已将一线胰腺癌 atebimetinib + mGnP 联合治疗组的目标入组患者人数增加到约 50 名。
所有结果均基于 2025 年 5 月 26 日的数据截止日期报告。
Immuneering 计划于 2026 年启动 atebimetinib 联合 mGnP 治疗一线胰腺癌患者的关键性试验。
消息公布后,公司股价盘前上涨 5.87%,市值约 9000 万美元。
原文链接:

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 50
50

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 44
44

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 42
42