 产业资讯
产业资讯
 研发客
研发客  2025-07-11
2025-07-11
 912
912
•中国iPSC疗法公司今年上半年总募资额约7200万美元;
•iPSC技术可以克服T细胞、NK细胞和间充质干细胞等原代细胞治疗的局限性;
•目前全球至少有155项iPSC疗法的临床试验正在进行;
•目前国内关于细胞治疗最为实质性的法规是《海南自由贸易港博鳌乐城国际医疗旅游先行区生物医学新技术促进规定》。
2025年过半,截止至6月30日,中国iPSC(诱导多能干细胞)疗法公司今年共有9家获得融资,总募资额约7200万美元,超过同期T细胞疗法(包括CAR-T和TCR-T疗法等)公司融资总额(约4100万美元)。
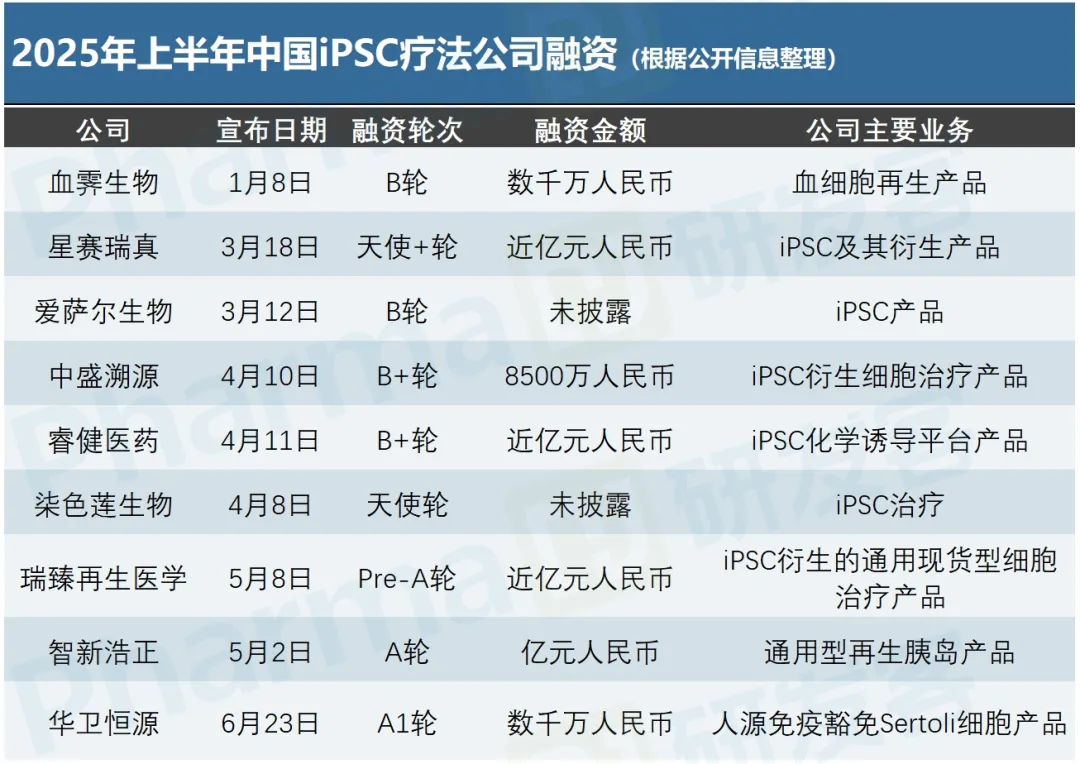
这也是近年来,iPSC疗法公司的融资额首次超过T细胞疗法公司(见下图)。
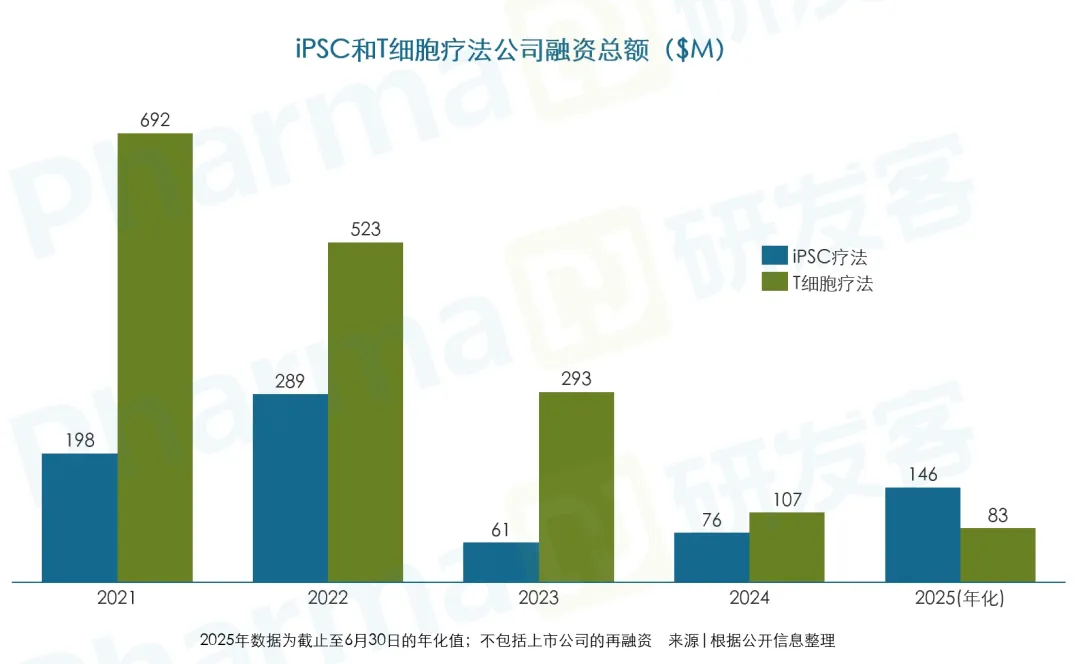
有望成为规模化和低成本的治疗方案
iPSC 技术由日本京都大学的山中伸弥(Shinya Yamanaka)与高桥和利(Kazutoshi Takahashi)于 2006 年首创,山中伸弥因此与约翰·格登爵士(Sir John Gurdon)共同获得了 2012 年诺贝尔奖。
基于iPSC技术的细胞治疗正成为再生医学的一个前沿方向,它可以克服T细胞、NK细胞和间充质干细胞等原代细胞治疗的局限性。例如,一些类型的细胞如神经元无法直接采集用于移植。此外,原代细胞的质量可能会受到疾病或种系突变的影响,表现出异质性。
而iPSC技术可以用来克服这些限制,因为iPSC可进行基因工程改造、克隆扩增,并分化为多数体细胞类型。且与胚胎干细胞相比,iPSC来源于体细胞,因而在伦理方面受到的限制更少。
异种移植实验已证明,iPSC技术可用于获取难以获得的细胞类型,可以改善疾病相关的组织功能障碍,并恢复体内稳态。据BioInformant,目前全球已经至少有155项iPSC疗法的临床试验正在进行。
尚无产品获批
CAR-T疗法已经在急性淋巴细胞白血病和大B细胞淋巴瘤上取得商业化成功,而iPSC领域则是另一派光景:由于迄今为止尚无产品获批,因此融资规模偏小;大型交易有限,主要集中在临床开发合作上。
据BioInformant报告,2021~2024年,iPSC领域共获得风险投资约34.2亿美元,其中2021年最高,为21.5亿美元(见下图)。
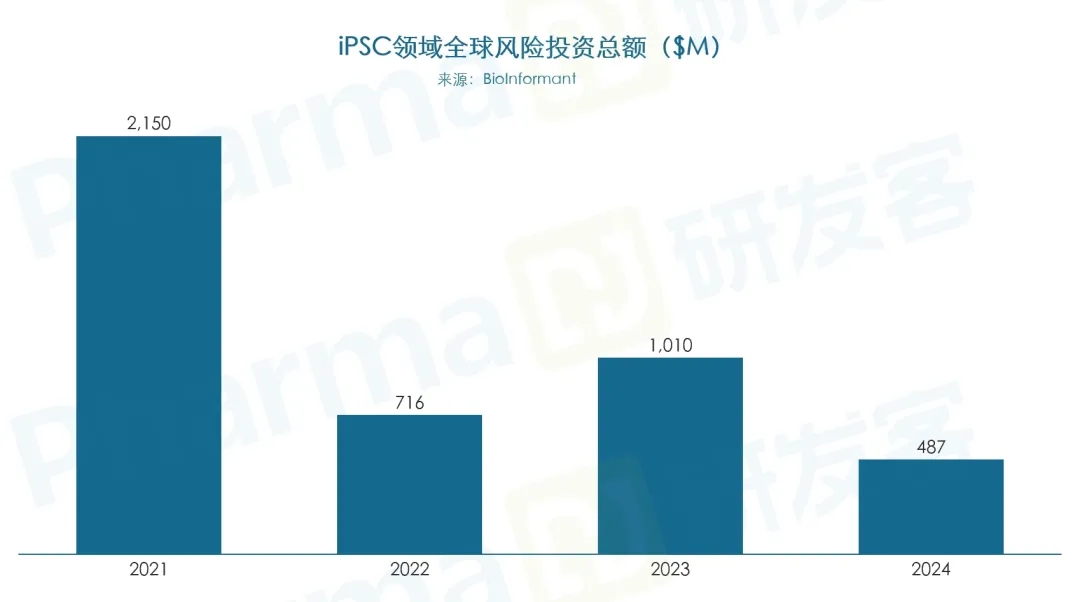
商业化曙光
相对于CAR-T疗法, iPSC具有成本低、可规模化生产、现成使用、治疗疾病广泛等优点。目前,异体iPSC产品的开发进展显著领先于自体疗法。不过,iPSC疗法仍处在研发阶段的早期,且在监管和生产上面临一些挑战(见下表)。
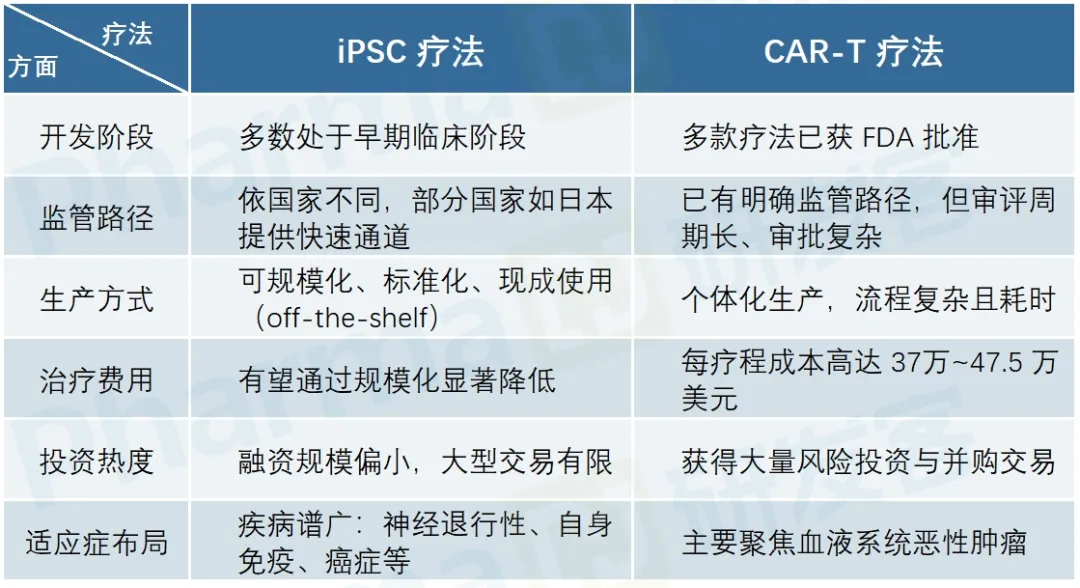
不过,商业化的曙光已经到来,干细胞产品近期在中美都有了商业化突破。
去年底,在两次被拒后,Mesoblast的间充质基质细胞(MSC)疗法Ryoncil终于获得了美国FDA的批准,成为该机构批准的首个干细胞治疗。
今年1月,中国国家药监局附条件批准铂生卓越生的MSC疗法艾米迈托赛注射液,该药成为中国首款获批上市的干细胞疗法。
这两款药物都用于急性移植物抗宿主病(aGVHD)的治疗。
相对于技术较为成熟的MSC,iPSC的潜力更大,应用更广泛。一旦监管和生产的瓶颈突破,未来可以在相对成本较低的情况下用于治疗多种疾病,特别是慢性疾病,如:癌症、糖尿病、神经退行性疾病、眼科以及多种免疫炎症疾病等。
而近年来,国家和各地方政府在干细胞技术方面出台了多项扶持措施。
去年2月,新修订的《产业结构调整指导目录》将细胞治疗药物、细胞培养列入鼓励类产业目录。5月,北京药监局核发了全国首张干细胞《药物生产许可证》。
12月,《海南自由贸易港博鳌乐城国际医疗旅游先行区生物医学新技术促进规定》正式发布,这是目前国内关于细胞治疗最为实质性的法规。之后海南先后公布了两批生物医学新技术转化应用实施目录,其中包括多项干细胞治疗。
刚刚过去的6月10日,中国国家药监局CDE发布《先进治疗药品的范围、归类和释义(征求意见稿)》,首次明确我国“先进治疗药品(ATMP)”分为细胞治疗药品(CTMP)、基因治疗药品(GTMPs)及其他类,为干细胞药物的注册申报与市场准入建立清晰的分类框架。而iPSC很可能成为干细胞技术落地的下一个风口。

 产业资讯
产业资讯
 医药财经
医药财经  2025-10-14
2025-10-14
 638
638

 产业资讯
产业资讯
 医药魔方Invest
医药魔方Invest  2025-10-14
2025-10-14
 647
647

 产业资讯
产业资讯
 同写意
同写意  2025-10-14
2025-10-14
 616
616