 医改专题
医改专题
 医药云端工作室
医药云端工作室  2025-07-17
2025-07-17
 1958
1958
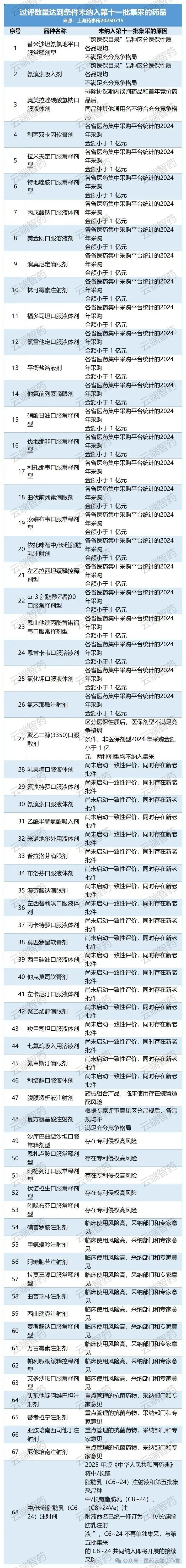
7月15日,国家组织药品联合采购办公室发布通知,启动第11批国家组织药品集中采购相关药品信息填报工作,并公布拟纳入第11批集采的清单,共计55个品种。
当天,国家医保局召开媒体通气会,介绍优化集采的措施。据了解,本次集采优化了品种遴选条件。55个品种如何而来?
会上,国家组织药品联合采购办公室(以下简称国家组织药品联采办)主任郑颐作了详细解读。“按照要求,我办以2025年3月31日为时间节点,沿用第10批集采‘参比制剂和通过一致性评价仿制药企业数达到7家及以上’作为第11批集采的品种遴选条件。”
郑颐介绍,品种信息来源包括三个方面:
一是中国医药工业信息中心提供的国家药监局化学药品目录集(内含参比制剂和过评药品信息),二是国家药监局公开发布的仿制药参比制剂目录(内含参比制剂信息),三是米内数据库的一致性评价进度信息(内含过评药品信息)。三方面来源的数据互为补充,取并集汇总后满足遴选条件品种数有122个。
在此基础上,国家组织药品联合采购办公室对拟纳入品种进行遴选,主要包括三个步骤。
第一步:结合医保目录、市场规模等进行筛选。
郑颐介绍,第11批集采聚焦临床使用成熟、市场竞争充分的品种,更好发挥集采的规模效应,在满足遴选条件的基础上,结合既往品种遴选规则和集采政策优化要求,排除存在以下情形的品种:
一是主要成分、给药途径和适应证相同但包含医保目录内品规和目录外品规的“跨医保目录”品种,区分为医保内、外分组采购,区分后不满足竞争格局的,不纳入。
此种情形共排除了替米沙坦氨氯地平口服常释剂型、氨溴索吸入剂2个品种,以及复方电解质注射剂、二甲双胍恩格列净口服常释剂型等7个品种的部分品规。
如替米沙坦氨氯地平口服常释剂型(总格局1+6,即参比制剂有1家企业,通过一致性评价有7家企业,下同),同属口服常释剂型的有2个品规,分别为替米沙坦氨氯地平片(1+4,医保)和替米沙坦氨氯地平片(Ⅱ)(0+4,自费),区分医保和自费性质后2个品规均未满足竞争格局,按此情形替米沙坦氨氯地平口服常释剂型不纳入。“
此条遴选规则也是为了保障患者医保报销的公平性,使用同一集采品种的不同患者的报销属性相同。”郑颐说。
二是协议期内的国家医保谈判药品、新进入医保目录首年的竞价药品不纳入,共排除奥美拉唑碳酸氢钠口服液体剂1个品种以及复方氨基酸注射剂、二甲双胍恩格列净口服常释剂型等3个品种的部分品规。
参照最新版《国家基本医疗保险、工伤保险和生育保险药品目录(2024年)》,国家医保目录中谈判药品协议期内暂不纳入集采,竞价药品沿用既往规则在新进入医保目录首年暂不纳入集采,次年如符合条件则纳入集采。
如奥美拉唑碳酸氢钠口服液体剂的“(Ⅱ)”品规在谈判协议期内,去除该品规后,其余品规竞争格局为“0+6”,不符合竞争格局条件,故该品种不纳入。二甲双胍恩格列净口服常释剂型的“(Ⅲ)”“(Ⅵ)”品规处于首年竞价药品,不纳入,去除该2品规后,其余品规仍满足竞争格局条件,保留。
三是2024年采购金额小于1亿元的品种不纳入,共排除他氟前列素滴眼剂、林可霉素注射剂等24个品种。国家组织药品联采办与国家医保局价采中心、首都医科大学国家医疗保障研究院三方背对背测算各品种省级平台采购金额,2024年采购金额小于1亿元的品种不纳入。
四是尚未启动一致性评价且新老批件并存的品种不纳入,共排除他克莫司软膏剂、利培酮口服液体剂等19个品种。
目前药监部门主要针对口服固体制剂和注射剂开展一致性评价工作,对口服溶液剂、吸入剂、滴眼剂、外用制剂等其他剂型的一致性评价工作方案正在研究中。
这类剂型药品中可能存在部分尚未开展一致性评价的老批件产品,以及部分近年来通过新注册分类获批的视同过评药品,考虑到国家组织集采的投标产品须通过或视同通过一致性评价,为保障竞争的公平性,这类药品不纳入。
五是存在装置适配风险的药械组合产品暂不纳入,共排除腹膜透析液注射剂(含普通和低钙)1个品种。
该药品属于药械组合产品,用于慢性肾功能衰竭透析。除药品本身外,需配合医疗器械装置使用,药品包装与装置之间的适配性可能影响患者用药安全。鉴于临床使用等风险,不纳入。排除上述情形的品种后,剩余75个品种。
第二步:征求临床医学和药学专家意见。
郑颐介绍,按照国家集采工作流程,国家组织药品联采办于2025年5月13日在北京召开临床和药学专家咨询会,从临床使用和药学特性等角度听取专家意见,包括:品种是否适合纳入本次集采、同品种不同品规间是否可替代、品种是否存在临床使用其他风险等。
结合临床专家意见,主要成分相同但使用装置、临床使用场景、作用时效等不完全相同的,区分为不同品种集采,不满足竞争格局的,不纳入。
共排除复方氨基酸注射剂1个品种以及丙卡特罗吸入剂等7个品种的部分品规,同时也有复方电解质注射剂1个品种区分后有2个品规均符合格局,按2个品种纳入。
如复方氨基酸注射剂包括15AA-Ⅱ、18AA-Ⅱ、18AA-Ⅶ、19AA-I、20AA等品规,临床专家提出不同数字代表所含氨基酸种类数和配方不同,临床使用场景有差异,需根据患者实际病情选择,不能相互替代,参比制剂也不同,应作为不同品种进行集采。
区分后,各品规竞争格局均不满足条件,故未纳入。综合专家共识,剩余75个品种。
第三步:根据相关部门及专家意见,进一步剔除存在相关风险的品种。
一是专利尚未到期且知识产权承诺企业数不满足遴选条件的品种暂不纳入。
结合相关部门意见和企业知识产权自主承诺情况,剔除阿格列汀口服常释剂型、伏诺拉生口服常释剂型、沙库巴曲缬沙坦口服常释剂型、恩扎卢胺口服常释剂型、吲哚布芬口服常释剂型等有重要专利尚未到期且知识产权承诺企业数不满足遴选条件的5个品种。
二是临床使用风险较高的品种不纳入。
采纳相关部门和专家意见,剔除万古霉素、麦考酚钠、拉莫三嗪、碘普罗胺注射剂、甲氨蝶呤、曲普瑞林等14个临床使用风险较高的品种。
这些药品是重点管理抗菌药物、窄治疗指数药物、容易发生严重不良反应的药物,以及辅助生殖技术相关药物等,这类药品对临床诊疗经验要求高、医师和患者用药习惯依从性强,为进一步保障集采结果平稳实施,暂不纳入本次集采。
例如,碘普罗胺注射剂(造影剂)属于高警示药物,易发生过敏性休克等严重不良反应,阿糖胞苷注射剂、甲氨蝶呤注射剂(白血病用药)涉及鞘内注射,通过腰椎穿刺将药物直接注入蛛网膜下腔,可能引发脑膜炎、颅内感染等,严重时危及生命。
另有中/长链脂肪乳(C6-24)1个品种,按照2025年版《中华人民共和国药典》其命名将与中/长链脂肪乳注射液C8-24、C8-24Ve合并,统一称为“中/长链脂肪乳注射液”。
而C8-24Ve为第五批集采品种,将于近期进行接续采购。临床医生、药师反映,上述品种在临床上可相互替代,合并命名更有利于临床用药管理。
因此,为平稳执行中选结果,中/长链脂肪乳(C6-24)注射液不再单独纳入第11批集采,与第五批集采品种中/长链脂肪乳(C8-24)、(C8-24Ve)注射液共同纳入接续采购。
郑颐介绍,经过三个阶段筛选,最终有55个品种纳入第11批集采报量范围。



 医改专题
医改专题
 中国保险
中国保险  2025-12-06
2025-12-06
 90
90

 医改专题
医改专题
 国家医保局
国家医保局  2025-12-05
2025-12-05
 119
119

 医改专题
医改专题
 医药云端工作室
医药云端工作室  2025-12-04
2025-12-04
 125
125