 研发追踪
研发追踪
 Insight数据库
Insight数据库  2025-07-18
2025-07-18
 948
948
7 月 17 日,CDE 官网显示,2 款新药上市申请获受理,分别是:1)第一三共注射用德曲妥珠单抗,Insight 数据库推测适应症为单药用于治疗既往接受过一种治疗方案的局部晚期或转移性 HER2 阳性成人胃或胃食管结合部腺癌患者;2)CSL 加达西单抗注射液,Insight 数据库推测适应症为遗传性血管性水肿。
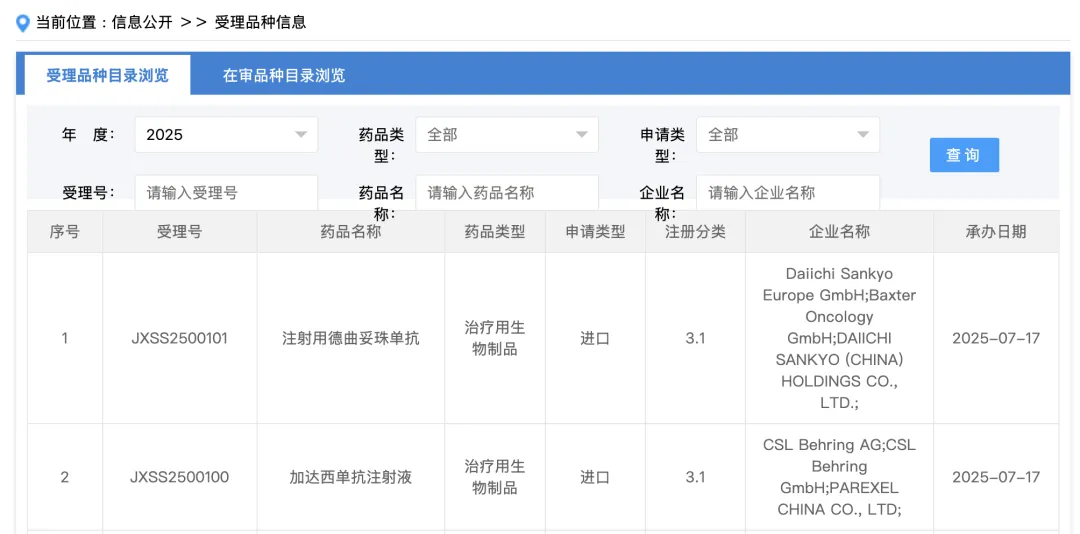
来源:CDE 官网
德曲妥珠单抗
第一三共注射用德曲妥珠单抗(T-DXd, DS-8201a)是一款 HER2 ADC,单药用于治疗既往接受过一种治疗方案的局部晚期或转移性 HER2 阳性成人胃或胃食管结合部腺癌患者适应症此前已被纳入优先审评。
德曲妥珠单抗是第一三共和阿斯利康旗下重磅 ADC 药物,自 2019 年首次获批以来,该药已在美国、日本、欧盟、中国等多个国家和地区获批上市。
在国内,德曲妥珠单抗已经获批四项适应症:
单药治疗既往接受过一种或一种以上抗 HER2 治疗、不可切除或转移性 HER2 阳性成人乳腺癌(2023/02);
单药治疗既往在转移性疾病阶段接受过至少 1 种系统治疗或在辅助化疗期间或完成辅助化疗之后 6 个月内复发,不可切除或转移性 HER2 低表达成人乳腺癌(2023/07);
单药治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性 HER2 阳性成人胃或胃食管结合部腺癌(2024/08);
用于治疗存在 HER2 激活突变且既往接受过至少一种系统治疗的不可切除或转移性成人非小细胞肺癌 (2024/10)。
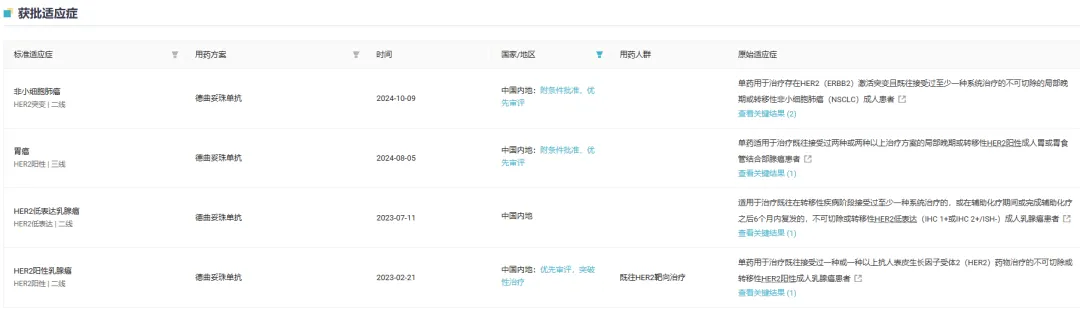
截图来源:Insight 数据库
刚刚结束的
ASCO 大会上,对比德曲妥珠单抗和雷莫西尤单抗 + 紫杉醇二线治疗 HER2 阳性不可切除/转移性胃癌或胃食管结合部腺癌的全球 III 期
DESTINY-Gastric04 随机对照研究结果以 LBA 口头报告(LBA4002)形式重磅发布。
德曲妥珠单抗组和对照组中位 OS 随访时间分别是 16.8 个月和 14.4 个月,结果显示德曲妥珠单抗可较雷莫西尤单抗 + 紫杉醇组显著改善生存,两组中位 OS 分别是 14.7 个月 vs 11.4 个月。2 年 OS 率分别是 29.0% vs 13.9%。
其他疗效终点方面,德曲妥珠单抗同样表现更优。两组中位 PFS 分别是 6.7 个月 vs 5.6 个月,cORR 分别是 44.3% vs 29.1%,DCR 分别是 91.9% vs 75.9%。
安全性方面,德曲妥珠单抗显示出和既往报道一致的良好安全性特征。两组 ≥ 3 级治疗出现不良事件(TEAEs)发生率分别是 68.0% vs 73.8%,严重 TEAEs 发生率分别是 41.0% vs 43.3%,和停药相关的 TEAEs 发生率分别是 14.3% vs 17.2%,德曲妥珠单抗组有 13.9% 的患者发生间质性肺病/肺炎,其中仅 1 例为 3 级,没有 4~5 级事件发生。未观察到新的安全性信号。
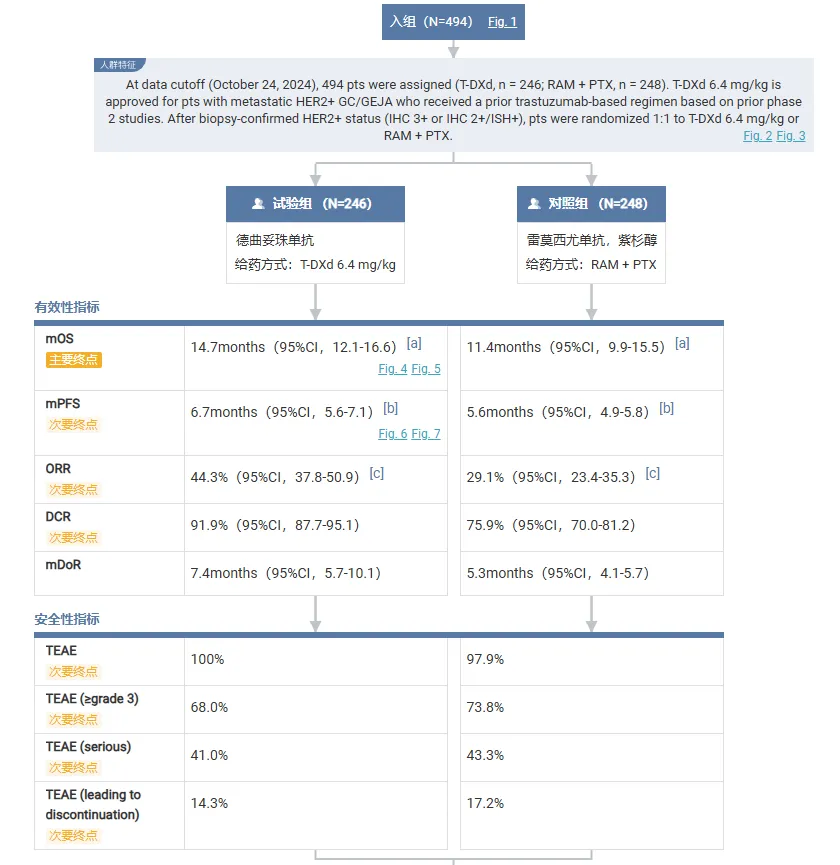
截图来源:Insight 数据库
加达西单抗
加达西单抗(Garadacimab)是一种新型的靶向活化型因子 XII(FXIIa)的单克隆抗体,今年 6 月获 FDA 批准上市,用于预防 12 岁及以上成人和儿童患者遗传性血管性水肿 (HAE) 的发作。此次在国内是通过免临床途径申报上市。
加达西单抗可通过每月一次皮下注射给药预防性治疗 HAE。研究表明,FXIIa 可启动导致 HAE 发作的级联反应。而 Garadacimab 靶向 FXIIa,可从源头抑制该级联反应,从而治疗 HAE。此前 Garadacimab 已获 FDA 和 EMA 授予孤儿药资格。
FDA 批准主要基于 VANGUARD 临床研究数据的支持。这是一项随机、双盲、安慰剂对照、平行组的全球多中心 III 期临床试验,旨在评估 Garadacimab 预防性治疗 HAE 的疗效和安全性。
结果显示,与安慰剂相比,每月皮下注射 Garadacimab 可显著降低 HAE 患者发作率。
Garadacimab 治疗组 62% 的患者在整个治疗期间未出现任何发作。
与安慰剂组相比,Garadacimab 组 HAE 发作次数中位数减少超过 99%,最小二乘均值为 89.2%。
与安慰剂组相比,Garadacimab 组需要按需治疗的 HAE 发作次数中位数减少超过 99%,平均减少 88%。
与安慰剂组相比,Garadacimab 组中度或重度发作次数中位数减少超过 99%,平均减少 90%。
关键性试验中最常见的不良反应是鼻咽炎和腹痛。
2025 年 2 月,CSL 公司发布了 Garadacimab 预防性治疗 HAE 的 III 期开放标签扩展研究的长期安全性和疗效中期分析数据。161名受试者的研究结果显示,Garadacimab 具有良好的安全性,适合长期使用,并可对 HAE 发作提供持久的保护。在关键性试验和开放标签扩展研究中,13% 患者报告了注射部位反应。根据 Insight 数据库,除 HAE 外,Garadacimab 还被开发用于特发性肺纤维化,目前正在美国、英国等多个国家开展 II 期临床试验。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 47
47

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 41
41

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 39
39