 研发追踪
研发追踪
 医药魔方
医药魔方  2025-07-18
2025-07-18
 1572
1572
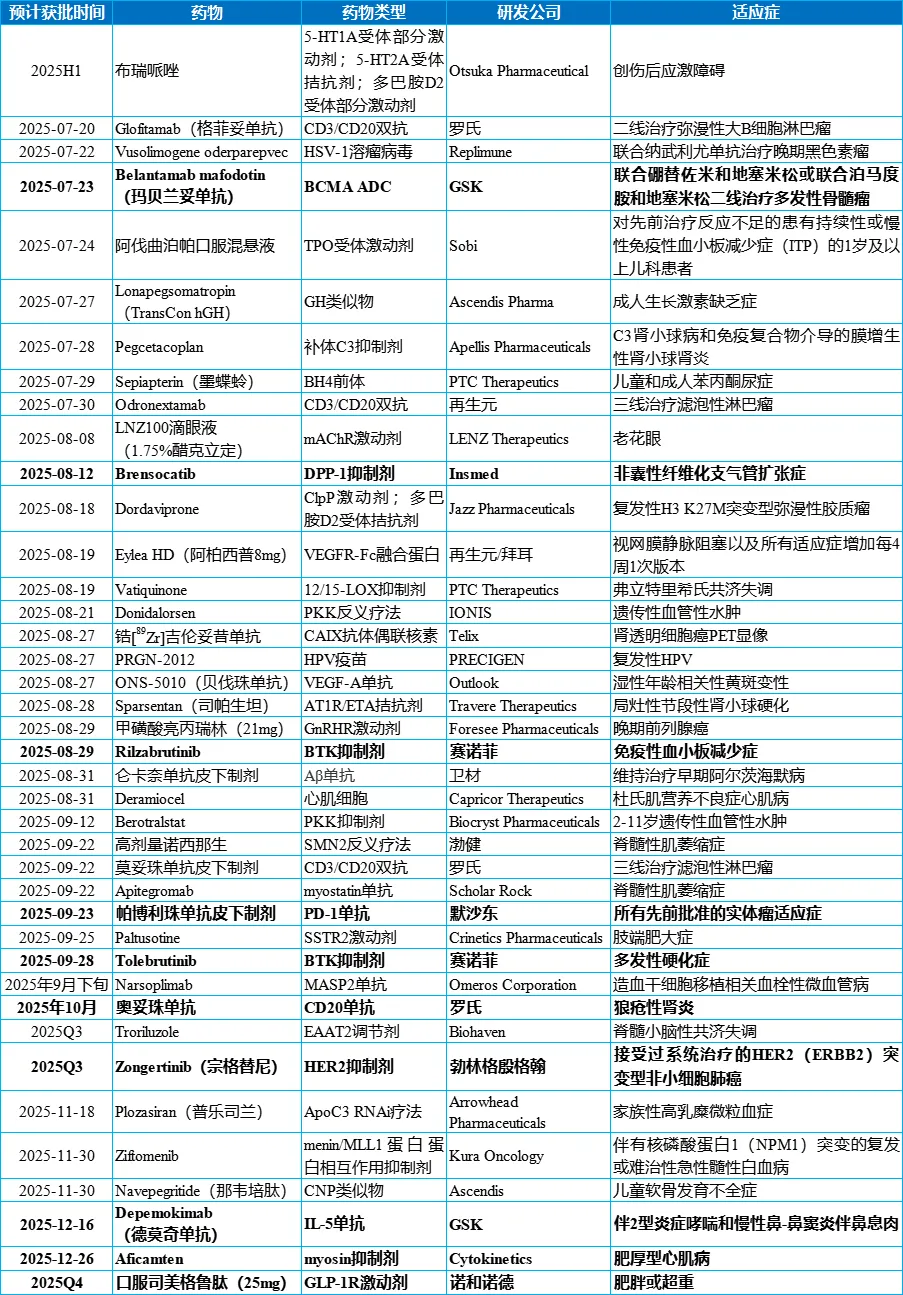
据不完全统计,下半年将有40项新药上市申请和新适应症上市申请排队等候FDA的批准。医药魔方从中筛选10项值得关注的申请进行介绍,供大家参考。
今年下半年FDA待审批新药/新适应症上市申请
药物:玛贝兰妥单抗
赛道排名:1/8
公司:GSK
PDUFA:2025-7-23
玛贝兰妥单抗(belantamab mafodotin)是一种靶向B细胞成熟抗原(BCMA)的ADC药物,于2020年8月凭借II期DREAMM-2研究获FDA加速批准上市,用于单药治疗既往接受过至少4种治疗(包括抗CD38单抗、蛋白酶体抑制剂和免疫调节剂)的复发或难治性多发性骨髓瘤(MM)成年患者。不过,因验证性III期DREAMM-3研究未能达到无进展生存期(PFS)主要终点,GSK在2022年和2023年将该药物相继从美国和欧洲撤市。
在DREAMM-7和DREAMM-8两项III期研究成功达到主要终点后,GSK再次递交了玛贝兰妥单抗的上市申请,用于联合硼替佐米与地塞米松(BVd)或联合泊马度胺与地塞米松(BPd)治疗既往接受过至少1种治疗的复发或难治性MM患者。
DREAMM-7研究结果显示,BVd组患者的PFS较对照组(达雷妥尤单抗+硼替佐米+地塞米松,DVd)显著延长(36.6个月 vs 13.4个月,HR=0.41,P<0.001)。DREAMM-8研究结果显示,BVd组患者的PFS较对照组(泊马度胺+硼替佐米+地塞米松,PVd)显著延长(尚未达到 vs 12.7个月,HR=0.52,P<0.001)。
药物:Brensocatib
赛道排名:1/12
公司:Insmed
PDUFA:2025-8-12
Brensocatib是阿斯利康开发的一款口服、可逆、小分子二肽基肽酶-1(DPP-1)抑制剂,通过抑制DPP-1阻止嗜中性粒细胞丝氨酸蛋白酶(NSP)活化,进而抑制中性粒细胞介导的炎症反应。2016年10月,与阿斯利康达成协议,获得Brensocatib的全球独家开发和商业化权益。
Brensocatib的上市申请是基于III期ASPEN研究的积极结果。该研究纳入了1721(其中包括41例青少年)例非囊性纤维化支气管扩张症患者。结果显示,治疗第52周时,10mg和25mg剂量组患者的年化肺部恶化发生率均低于安慰剂组(1.02 vs 1.29,比率为0.79,P=0.004;1.04 vs 1.29,比率为0.81,P=0.005),首次恶化时间的风险比分别为0.81(P=0.02)和0.83(P=0.04)。
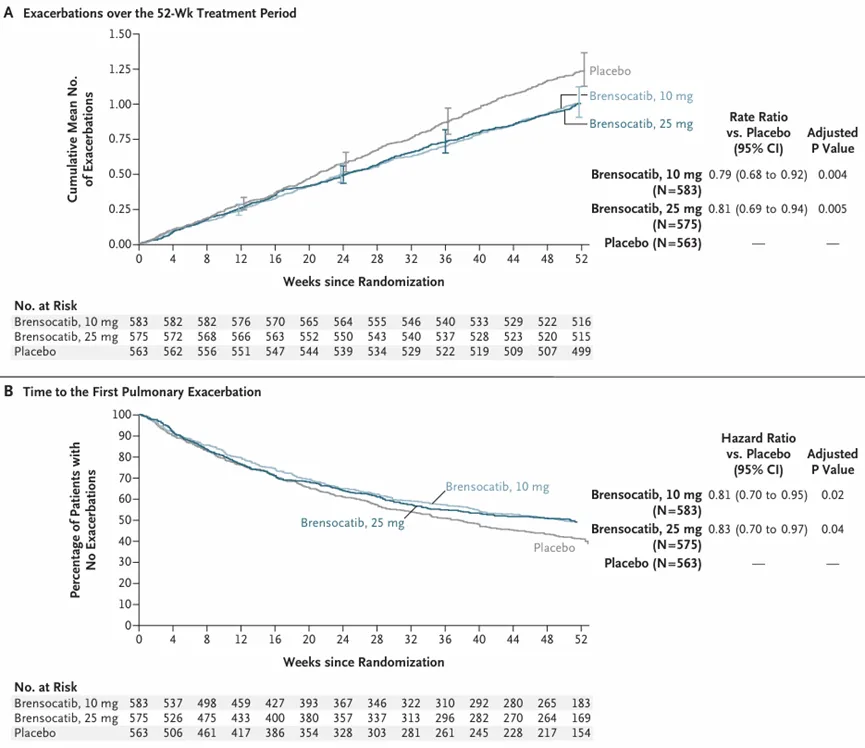
此外,10mg、25mg剂量组和安慰剂组在第52周时仍未出现恶化的患者比例分别为48.5%、48.5%和40.3%,差异具有统计学意义(比率为1.20,P=0.02;比率为1.18,P=0.04)。在1秒内用力呼气容积(FEV1)变化方面,10mg剂量组与安慰剂组之间无显著性差异(50mL
vs 62mL,最小二乘平均差为11mL,P=0.38),但25mg剂量组与安慰剂组之间的差异具有统计学意义(24mL vs
62mL,最小二乘平均差为38mL,P=0.04)。

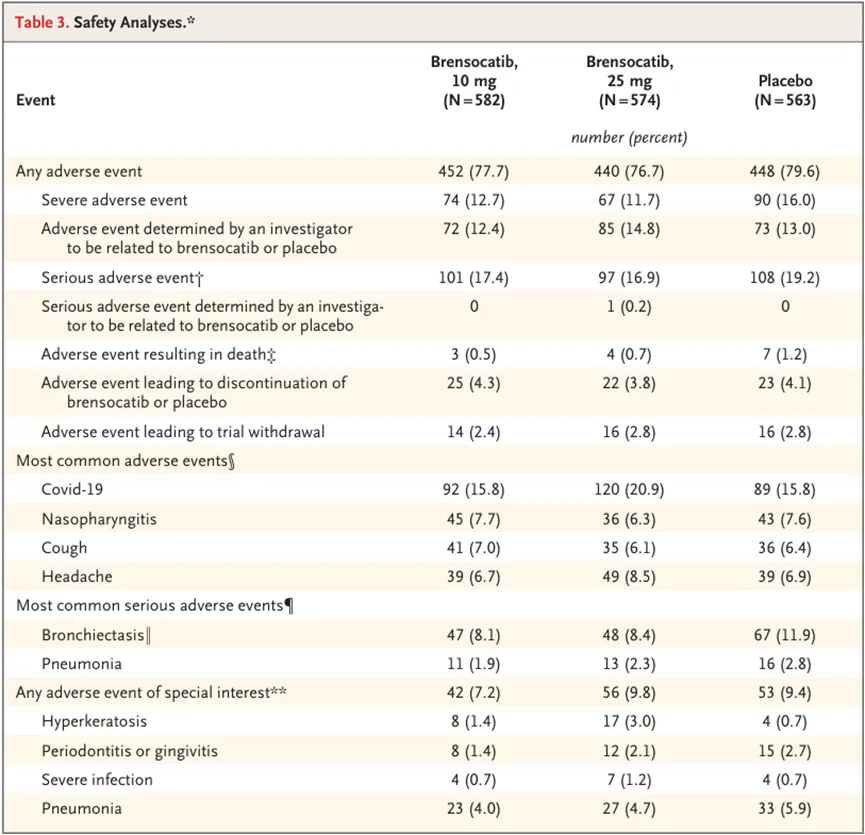
安全性方面,各组的不良事件发生率相似,但Brensocatib组的过度角化发生率较高(1.4% vs 3.0% vs 0.7%)。
支气管扩张症是一种严重的慢性肺部疾病,支气管因感染、炎症和肺组织损伤的循环而永久扩张,其特征为频繁的肺部恶化,需要抗生素治疗和/或住院治疗。疾病症状包括慢性咳嗽、痰液分泌过多、呼吸急促和反复呼吸道感染,这些症状可能使潜在疾病恶化。据统计,美国大约有50万例患者,欧盟五国(法国、德国、意大利、西班牙和英国)大约有60万例患者,日本大约有15万例患者,但全球尚无相关疗法获批。
药物:Rilzabrutinib
赛道排名:6/52
公司:Principia Biopharma(赛诺菲)
PDUFA:2025-8-29
Rilzabrutinib是一种口服、可逆、共价BTK抑制剂。BTK在B细胞、肥大细胞和其他与先天免疫应答相关的细胞中表达,参与多种免疫性疾病的发生发展过程。
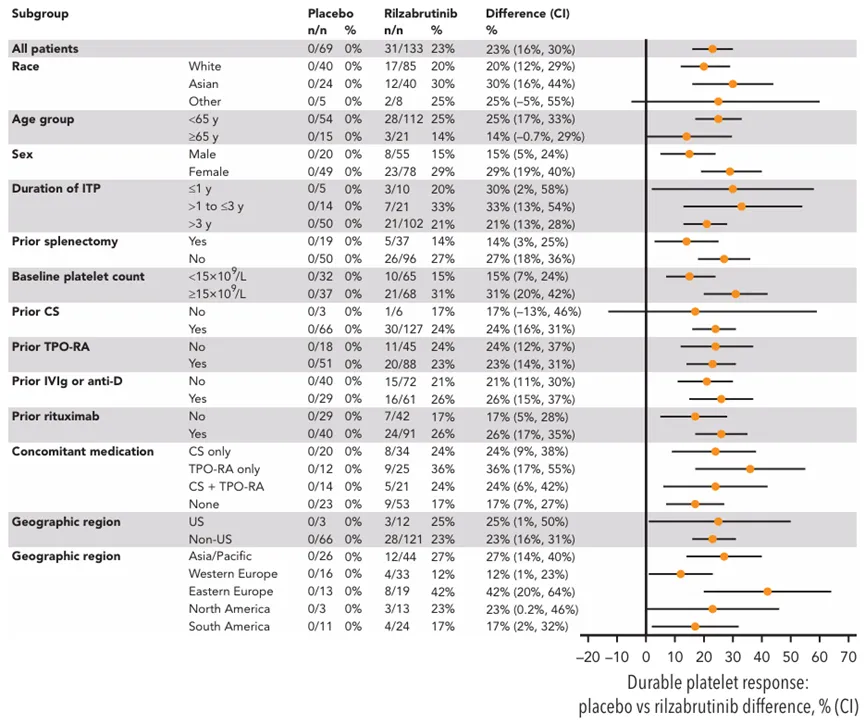
Rilzabrutinib的上市申请是基于III期LUNA 3研究的积极数据。结果显示,在既往接受过治疗的持续性或慢性免疫性血小板减少症(ITP)患者中,Rilzabrutinib组产生持久血小板应答(即在没有挽救治疗的情况下,患者在24周双盲治疗期的最后12周中至少有8周血小板计数≥50000/μL)的患者比例显著高于安慰剂组(23% vs 0%,P<0.0001)。
ITP是一种严重的获得性自身免疫性血液疾病,其特征是自身抗体介导的血小板破坏和血小板生成受损,导致血小板计数减少(<100000/μL)和危及生命的出血(如颅内出血)风险增加。此外,ITP患者的生活质量也会因此受到严重影响,例如容易疲劳和出现认知功能障碍。
药物:Zongertinib(宗格替尼)
赛道排名:4/35
公司:勃林格殷格翰
PDUFA:2025Q3
Zongertinib是勃林格殷格翰开发的一种口服、不可逆、选择性HER2抑制剂,能够与野生型和突变型HER2受体(包括携带外显子20突变)的酪氨酸激酶结构域(TKD)共价结合。2024年4月,中国生物制药与勃林格殷格翰签署战略合作协议,共同在中国大陆研发和商业化后者的肿瘤管线,其中包括Zongertinib。
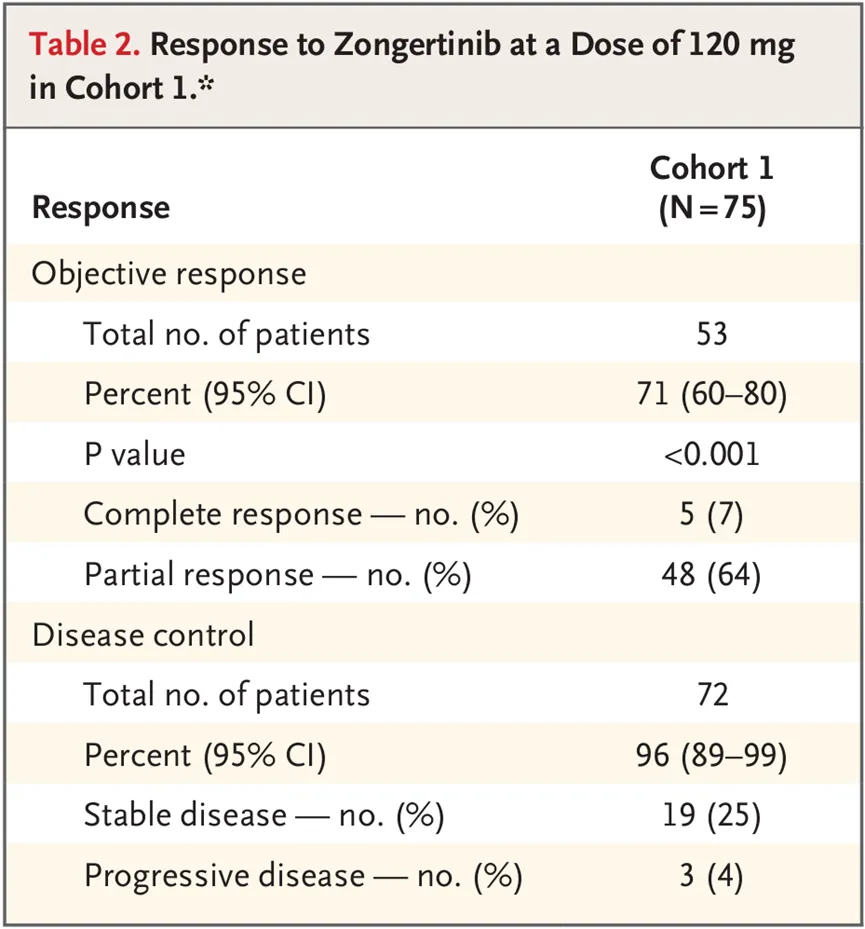
Zongertinib的上市申请是基于Ib期Beamion LUNG-1研究队列1的积极数据。该队列包含75例既往接受过治疗的HER突变非小细胞肺癌(NSCLC)患者。结果显示,患者经Zongertinib(120mg,每日1次)治疗后,71%实现了确认的客观缓解,中位缓解持续时间(DOR)为14.1个月,中位PFS为12.4个月。安全性方面,13例患者发生3级及以上治疗相关不良事件(TRAE)。没有患者出现药物相关间质性肺病。
药物:帕博利珠单抗皮下制剂
赛道排名:/
公司:默沙东
PDUFA:2025-9-23
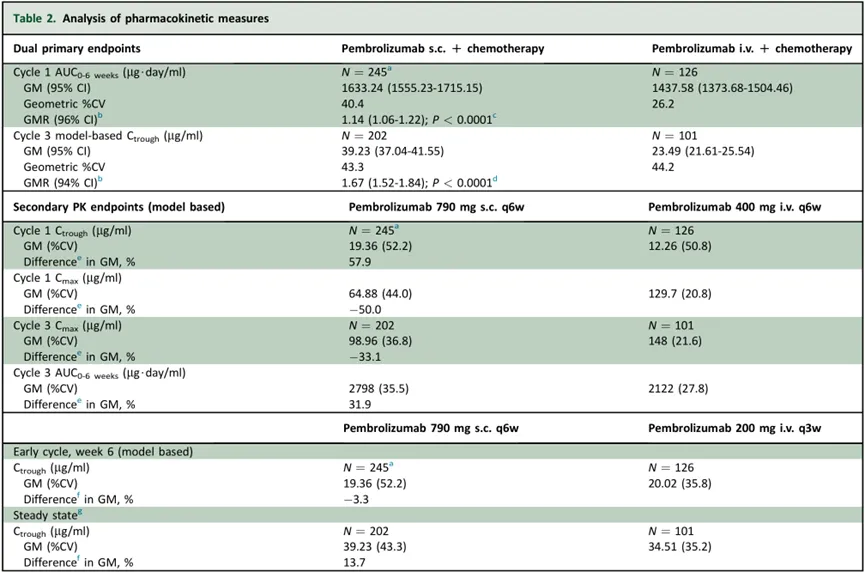
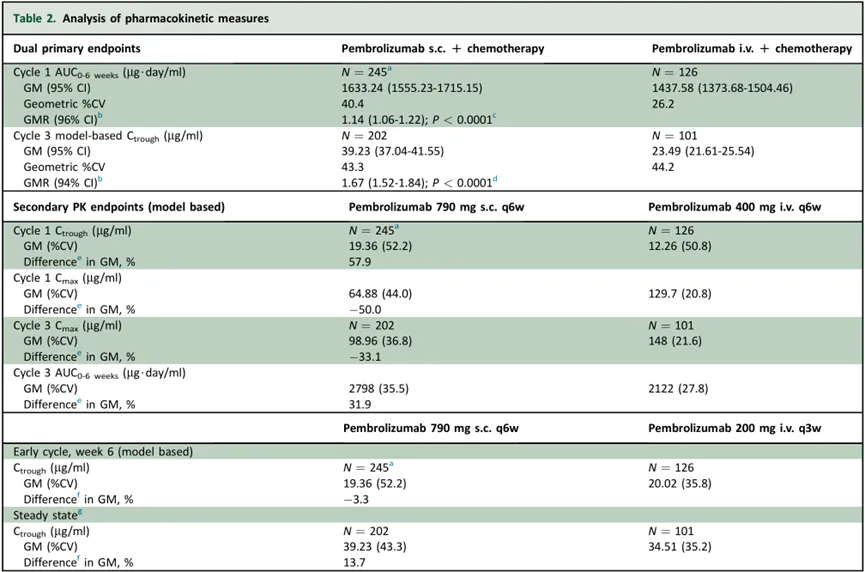
帕博利珠单抗皮下制剂(MK-3475A)的上市申请是基于III期MK-3475A-D77研究的积极数据。该研究共纳入378例不存在EGFR敏感突变、ALK或ROS1改变的新诊断转移性NSCLC成人患者。
在该研究中,帕博利珠单抗皮下制剂的中位注射时间为2分钟。结果显示,与帕博利珠单抗静脉制剂(400mg,每6周1次)相比,帕博利珠单抗皮下制剂(790mg,每6周1次)在首个给药周期内,帕博利珠单抗的药时曲线下面积(AUC)暴露量显示出非劣效性(P<0.0001),且在之后的稳态下测得的帕博利珠单抗谷浓度(Ctrough)也显示出非劣效性(P<0.0001)。
此外,皮下制剂和静脉制剂在疗效和安全性次要终点上的表现基本一致,客观缓解率(ORR)分别为45.4%和42.1%,PFS分别为8.1个月和7.8个月,3-5级治疗相关不良事件(TRAE)发生率分别为47.0%和47.6%,严重TRAE发生率分别为21.1%和19.8%。
药物:Aficamten
赛道排名:2/11
公司:Cytokinetics
PDUFA:2025-9-26
Aficamten是Cytokinetics开发的一款新一代选择性小分子心肌肌球蛋白(myosin)变构抑制剂,可以通过抑制肌球蛋白-肌动蛋白横桥的过度形成来抑制与肥厚型心肌病(HCM)相关的心肌过度收缩。2020年7月,Cytokinetics授予箕星药业在大中华地区的开发和商业化Aficamten的独家许可权益。2024年12月,赛诺菲出手收购箕星药业持有的Aficamten权益。
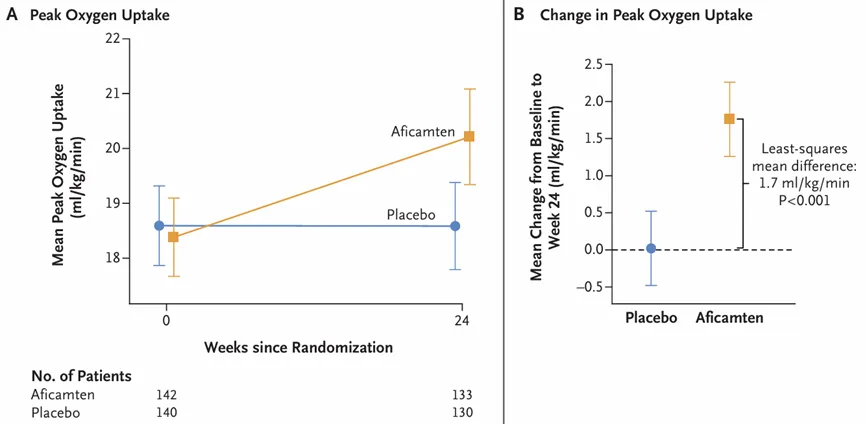
Aficamten的上市申请是基于III期SEQUOIA-HCM研究的积极结果。该研究纳入了282例有症状的梗阻性HCM患者,评估了Aficamten(起始剂量5mg,最大剂量20mg)对比安慰剂的疗效和安全性。
结果显示,治疗第24周,Aficamten组患者的运动能力显著提高,经心肺运动试验(CPET)评估的峰值摄氧量(pVO2)显著增加(1.8 vs 0.0 mL/kg/min,最小二乘差为1.7mL/kg/min,P<0.001)。此外,该研究也达到了所有次要终点(P<0.001)且数据具有临床意义,包括堪萨斯城心肌病问卷临床综合评分(KCCQ-CSS)变化、纽约心脏协会(NYHA)功能分级改善≥1级的患者比例、左心室流出道压力阶差(LVOT-G)变化等指标。
HCM是最常见的遗传性心血管疾病,由于早期筛查手段的限制,HCM患病率很可能被低估。目前估计其患病率计至少为1/200。其中,临床上梗阻性(静息和隐匿)HCM约占2/3,非梗阻性HCM约占1/3。HCM可导致劳力性呼吸困难、疲劳、胸痛、心悸、晕厥/先兆晕厥、运动功能受限。另外,HCM是青少年和运动员猝死的主要原因之一,与疾病相关的致死及致残事件可归因于心脏性猝死、心力衰竭和栓塞性卒中。
药物:Tolebrutinib
赛道排名:8/52
公司:赛诺菲
PDUFA:2025-9-28
Tolebrutinib是一种口服、脑渗透性BTK抑制剂,能够直接作用于中枢神经系统内的小胶质细胞和B细胞,从而抑制神经炎症和脱髓鞘过程,这使得其具备治疗多发性硬化症的潜力。
Tolebrutinib的上市申请是基于三项III期研究的数据。针对非复发性继发进展型多发性硬化症(nrSPMS)的HERCULES研究表明,Tolebrutinib组确认残疾进展的患者比例较安慰剂组更低(21.9% vs 30.2%,HR=0.69,P=0.003)。
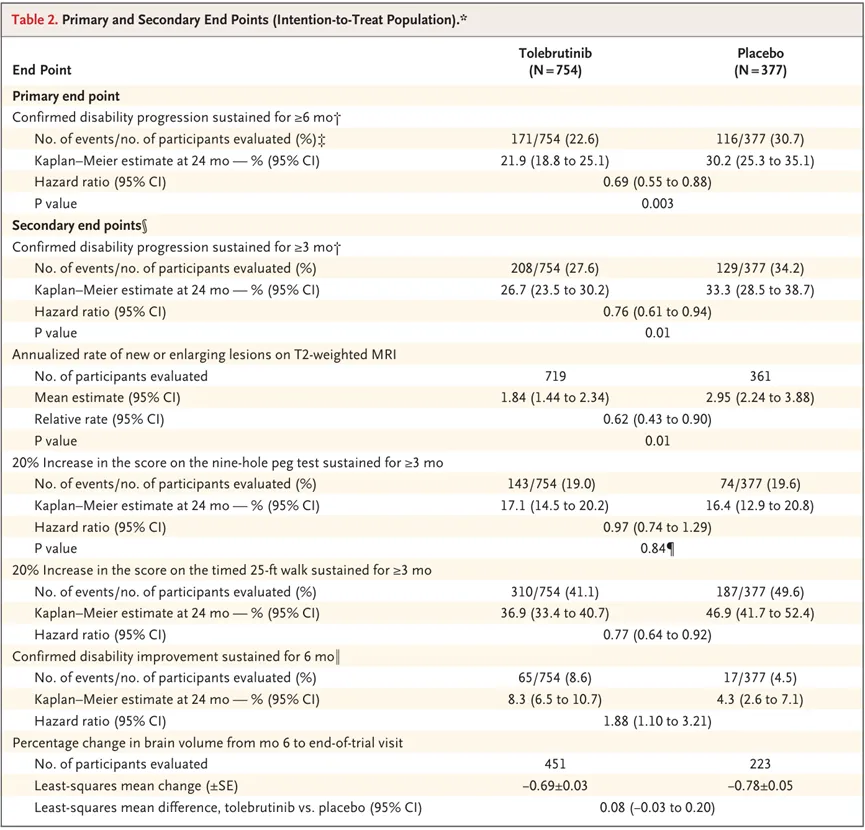
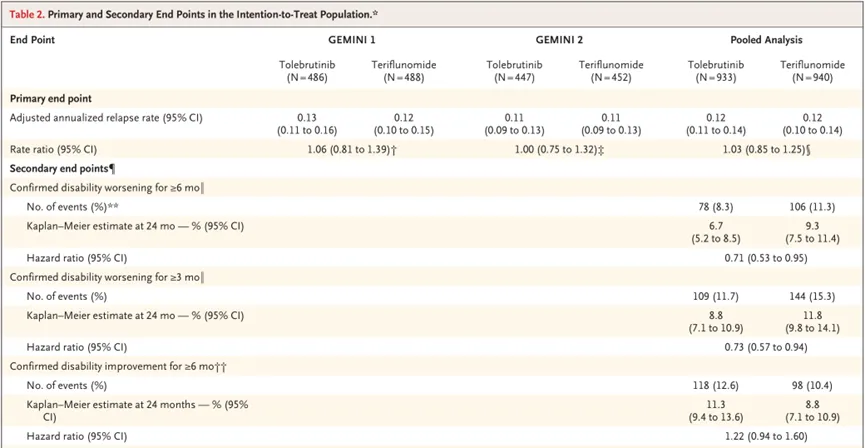
针对复发性多发性硬化症(RMS)的GEMINI 1研究和GEMINI
2研究未达到主要终点,即Tolebrutinib组的年化复发率与特立氟胺组之间无显著性差异(GEMINI 1研究:0.13 vs
0.12,P=0.67;GEMINI 2研究:0.11 vs 0.11,P=0.98)。
药物:奥妥珠单抗
赛道排名:3/16
公司:罗氏
PDUFA:2025年10月
奥妥珠单抗是罗氏开发的一款Fc片段经过修饰的CD20单抗,其补体依赖的细胞毒性作用(CDC)被弱化但抗体依赖的细胞毒性作用(ADCC)和抗体依赖的细胞吞噬作用(ADCP)得到了增强,并且具有更强的直接B细胞杀伤效应。目前该药物已获批用于治疗慢性淋巴细胞白血病、滤泡性淋巴瘤、小淋巴细胞性淋巴瘤。
狼疮性肾炎适应症的上市申请是基于III期REGENCY研究的积极结果。该研究纳入了271例活动性狼疮性肾炎患者,评估了奥妥珠单抗联合标准治疗(吗替麦考酚酯+泼尼松)对比标准治疗的有效性和安全性。
结果显示,在治疗第76周时,奥妥珠单抗组实现完全肾脏缓解(CRR)的患者比例更高(46.4% vs 33.1%,调整后差异为13.4%,P=0.02)。在第64-76周期间接受≤7mg/日泼尼松治疗的患者中,奥妥珠单抗组在第76周时实现CRR的患者比例更高(42.7% vs 30.9%,调整后差异为11.9%,P=0.04)。此外,奥妥珠单抗组在第76周时实现尿蛋白肌酐比值(UPCR)低于0.8且无并发症的患者比例也更高(55.5% vs 41.9%,调整后差异为13.7%,P=0.02)。
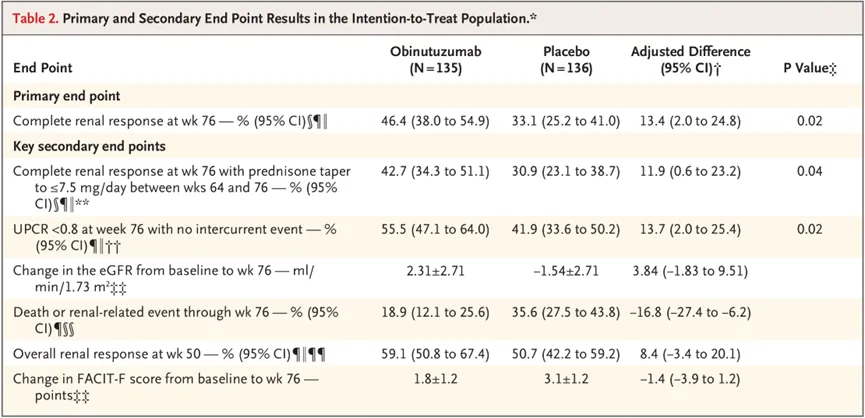
与此同时,奥妥珠单抗组相较于标准治疗组的补体水平也实现了具有临床意义的改善,抗dsDNA抗体水平、疾病活动度和炎症标志物水平也有所降低。
药物:口服司美格鲁肽(25mg)
赛道排名:/
公司:诺和诺德
PDUFA:2025Q4
此次上市申请是基于III期OASIS 4研究的积极结果。该研究共纳入了307例伴有至少一种体重相关并发症(高血压、血脂异常、阻塞性睡眠呼吸暂停或心血管疾病)的超重(BMI≥27kg/m2)或肥胖(BMI≥30kg/m2)成人受试者。
受试者的体重基线为105.9kg。结果显示,治疗第64周,25mg口服司美格鲁肽组受试者的体重下降了13.6%,而安慰剂组这一比例为2.2%。如果所有受试者均坚持完成了治疗,则25mg口服司美格鲁肽组的体重降幅为16.6%,安慰剂组降幅为2.7%。此外,25mg口服司美格鲁肽在研究中显示出了良好的安全性和耐受性。
司美格鲁肽口服片剂(商品名:Rybelsus)于2019年9月在美国获批上市,剂量为7mg和14mg,适应症为2型糖尿病。除了25mg口服剂量外,诺和诺德也开发了50mg口服司美格鲁肽,目前已启动三项III期研究(OASIS 1-3)评估其减重效果,其中OASIS 1研究已顺利完成。
药物:Depemokimab(德莫奇单抗)
赛道排名:3/5
公司:GSK
PDUFA:2025-12-16
Depemokimab是GSK开发的新一代超长效IL-5单抗,具有更长的半衰期、高结合亲和力和高效力,仅需每半年注射一次。此前,GSK开发的第一代IL-5单抗美泊利珠单抗(商品名:Nucala)为每月1次制剂,已于2015年11月在美国获批上市。据GSK财报,2024年美泊利珠单抗全球销售额约为22.20亿美元。
哮喘适应症的上市申请是基于两项III期研究(SWIFT-1和SWIFT-2)的积极结果。这两项研究共纳入了792例嗜酸性粒细胞表型重度哮喘患者。结果显示,治疗52周后,Depemokimab(100mg,皮下注射,每26周1次)联合标准治疗组患者的年化哮喘恶化率较安慰剂联合标准治疗组显著降低(SWIFT-1研究:0.46 vs 1.11,P<0.001;SWIFT-2研究:0.56 vs 1.08,P<0.001)。不过,在两项研究中,Depemokimab组与安慰剂组的圣乔治呼吸问卷(SGRQ)评分变化组间差异均无统计学意义。
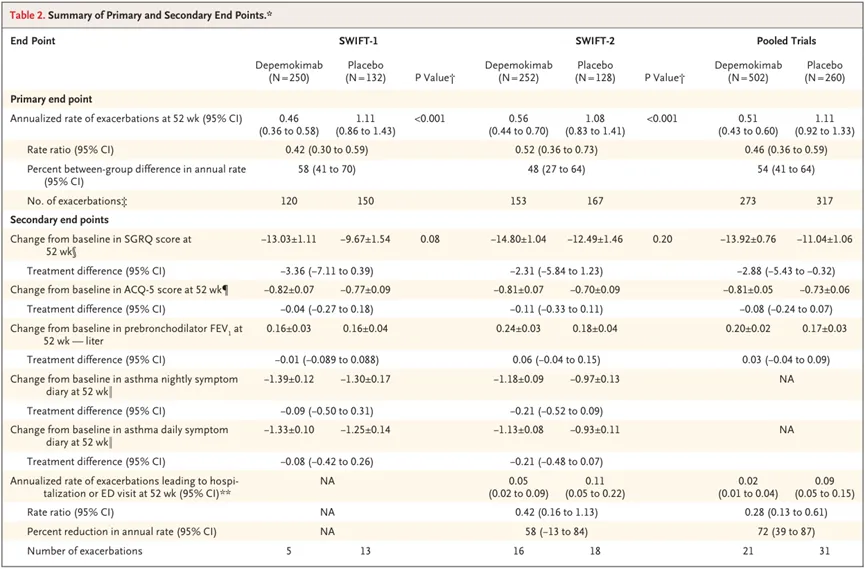
慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)适应症的上市申请是基于两项III期研究(ANCHOR-1和ANCHOR-2)的积极结果。这两项研究共纳入了540例CRSwNP患者。结果显示,治疗52周后,Depemokimab(100mg,皮下注射,每26周1次)组患者的总鼻内窥镜鼻息肉评分较安慰剂组显著降低(ANCHOR-1研究:最小二乘差为-0.7,P<0.001;ANCHOR-2研究:最小二乘差为-0.6,P=0.004),第49-52周经口述评定量表(VRS)评估的鼻塞评分同样显著降低(ANCHOR-1研究:最小二乘差为-0.23,P=0.047;ANCHOR-2研究:最小二乘差为-0.25,P=0.025)。此外,在两项试验中,Depemokimab和安慰剂组的治疗期间不良事件(TEAE)总体发生率及严重程度相似。

 研发追踪
研发追踪
 医麦客
医麦客  2026-02-12
2026-02-12
 47
47

 研发追踪
研发追踪
 研发客
研发客  2026-02-12
2026-02-12
 41
41

 研发追踪
研发追踪
 丁香园Insight数据库
丁香园Insight数据库  2026-02-12
2026-02-12
 39
39